Miért esik az Arrhenius-egyenlet mindig az "exponenciálisan növekvõ" tartományba, amikor a kémiai kinetikát vizsgáljuk?
A fordítás Harvey F. Carroll írása alapján készült (Journal of Chemical Education, 1998., 75. k., 9. sz., 1186–1187. o.), a JCE engedélyével. A Journal of Chemical Education lapjait a http://jchemed.chem.wisc.edu/ címen érheti el.
Az általános kémiai tankönyvekben a sebességi állandóról rendszerint azt mondják vagy azt tételezik fel, hogy a hõmérséklet exponenciális függvénye, majd azt állítják, hogy ezt a jelenséget az Arrhenius-egyenlet önti matematikai formába:
ahol k a sebességi állandó, A a preexponenciális vagy frekvenciafaktor, Ea az aktiválási energia, R=8,315 Jmol–1K–1 a gázállandó, T az abszolút hõmérséklet.
Aki az Arrhenius-egyenlet tulajdonságait akarja felvázolni a hallgatóknak, valószínûleg a következõ egyszerû exponenciális egyenletet használja modellként:
![]()
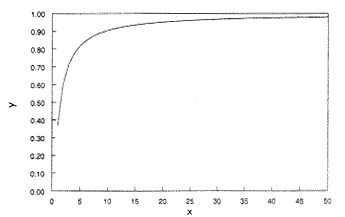
Általában feltételezzük, hogy ez egy exponenciális
növekvõ függvény. De amint az 1. ábra mutatja,
ez a függvény 1-hez tart aszimptotikusan, miközben x
tart a végtelenhez, és a grafikonon megadott tartományban
egyaltalán nem fest exponenciálisan növekvõ függvényként.
 |
 |
| 1. ábra. Az |
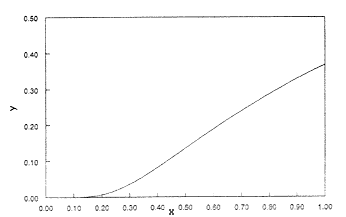
2. ábra. Az |
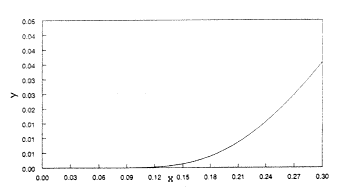
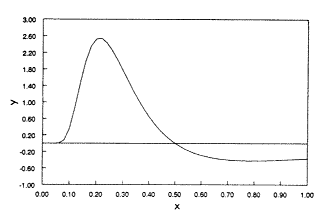
Ha azonban x 0 és 1 között változik, akkor úgy látszik, hogy a görbének "exponenciálisan növekvõ"1 tartománya és inflexiós pontja is van (2. ábra). Még kisebb x-értékeknél jól látszik, hogy a görbe "exponenciális" (3. ábra).
Az elsõ derivált, amelynek az inflexiós pontban maximuma van:
![]()
 |
 |
| 3. ábra. Az |
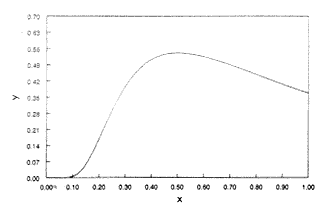
4. ábra. Az |
Ha y'-t ábrázoljuk x függvényében (4. ábra), látszik, hogy a deriváltnak 0,5 körül maximuma van. A második derivált megadja az inflexiós pont pontos helyét is:
![]()
Az 1 – 2x = 0 esetben x-re 0,5 adódik. Tehát
az inflexiós pont x = 0,5-nél van (5. ábra).
 |
 |
| 5. ábra. Az |
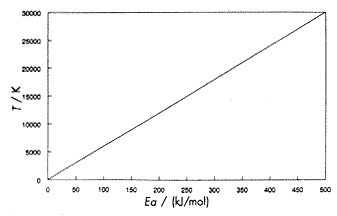
6. ábra Az inflexiós ponthoz tartozó hõmérséklet
az
aktiválási energia függvényéban |
Térjünk most vissza az Arrhenius-egyenlethez és a kémiai kinetikához. Az egyszerûség kedvéért legyen Ea/R = a. A második derivált megadja az inflexiós pont pontos hõmérsékletét:
![]()
Az inflexiós pontot ismét úgy határozzuk meg, hogy az (a – 2T) kifejezést egyenlõvé tesszük 0-val, ekkor:
![]()
Ezt a függvényt ábrázolja a 6. ábra.
A grafikon úgy értelmezhetõ, hogy bármely aktiválási
energia esetén rendkívül nagy hõmérséklet
szükséges ahhoz, hogy elérjük az Arrhenius-egyenlet
nem "exponenciális" tartományát. Egy 200 kJ/mol aktiválási
energiájú reakció esetén ez a hõmérséklet
12 000 K körül lenne, egy 60 kJ/mol aktiválási
energiájú reakciónál 3600 K körül.
A kémiai kinetikai vizsgálatok elég alacsony hõmérsékleten
zajlanak ahhoz, hogy az Arrhenius-egyenlet mindig az "exponenciális
emelkedõ" tartományban legyen.
Megjegyzés
1. Azért teszem idézõjelbe az "exponenciálisan növekvõ" kifejezést az