Michael Faraday
Az elektrokémiai bomlásról
Philosophical Transactions of the Royal Society, 1834
(A ChemTeam
gyûjteményében megjelent cikkrészletek alapján)
Azon elméletet, amely vélekedésem szerint hiteles
magyarázatát adja az elektrokémiai bomlás tényeinek,
s amelyet ezen elõadások egy korábbi sorozatában
részleteztem, a legutóbbi haladásra való tekintettel
jelentõsen módositani kell. Az eredmények kifejtése
során komoly nehézségekkel találtam szembe
magam, melyeken szerintem úgy lehet úrrá lenni, ha
körülhatároljuk bizonyos általánosan használt
kifejezések értelmét, illetve újakat vezetünk
be. Ilyen például a pólus kifejezés,
a vonzás és a taszítás hozzá kapcsolódó
elképzelésével együtt. Az általánosan
használt frazeológia szerint a pozitív pólus
vonzza
az oxigént, illetve a savakat stb., vagy óvatosabban fogalmazva
ez determinálja ezek kifejlõdését saját
felületén; hasonló módon hat a negatív
pólus a hidrogénre, az éghetõ anyagokra, a
fémekre, illetve a bázisokra. Nézetem szerint ez a
meghatározó erõ nem a pólusokban, hanem
a bomló anyagok belsejében van; s így az oxigén,
illetve a savak e testek negatív, míg a hidrogén,
a fémek stb. a pozitív "végén" fejlõdnek,
keletkeznek.
A zavar és a mellébeszélés elkerülésére,
valamint az eddig megszokottnál pontosabb terminológia kiejlesztése
érdekében két barátommal is átgondolva
a felmerülõ kérdéseket, az alábbi új,
illetve újonnan definiált kifejezések használatát
javaslom. A pólusok, amint általában nevezik
õket, csupán azok az "ajtók" vagy "utak", melyeken
át az elektromos áram belép a szétbontandó
testbe, illetve elhagyja azt; s melyek természetesen, amikor érinkezésben
vannak vele, ez utóbbi test kiterjedésének határát
képezik az áram irányában. E kifejezést
általában a bontandó anyaggal érintkezésben
lévõ fémfelületekre alkalmazzák; de általánosságban
levegõ-, illetve vízfelületekre is alkalmazható,
melyeken, véleményem szerint, elektrokémiai bomlás
végbemenetele erõsen kétséges. A pólus
szó helyett javaslom az elektród [1] kifejezés
használatát, amely alatt olyan anyagot vagy inkább
felületet értek, amely lehet levegõ, víz, fém
vagy bármi más, s az áram irányában
határolja a bontandó anyag kiterjedését.
Azok a felületek, melyeken át az általánosan
használt frazeológia szerint az elektromos áram belép
a felbontandó testbe, illetve elhagyja azt, a legfontosabb történések
helyszínei. Igen fontos ezért, hogy pontosan megkülönböztessük
ezeket a pólusoktól, melyekkel legtöbbször, illetve
az elektródoktól, melyekkel mindig érinkezésben
vannak. Nevezzük ezért anódnak [2] azt a felületet,
amelyen át az elektromos áram, mai tudásunk szerint,
érkezik: ez a felbontandó test negativ "széle";
itt fejlõdik az oxigén, a klór, a savak stb.; s a
pozitív elektróddal áll szemben. A katód
[3]
az a felület, amelyen át az elektromos áram elhagyja
a felbontandó testet, ez annak pozitív "széle";
itt fejlõdnek az éghetõ anyagok, fémek, alkáliák
és a bázisok, s ez a negatív elektródhoz kapcsolódik.
Úgy vélem, a jelen okfejtés alkalmat ad arra, hogy
a testeket elektromos viselkedésükbõl kikövetkeztethetõ
rokonságuk alapján osztályozzam; s mivel ezt akként
akarom megtenni, hogy az ez alkalommal használt kifejezések
egyszersmind ne tartalmazzanak hipotetikus elemeket, ezért az alábbi
neveket, illetve terminusokat szándékozom használni.
Számos test közvetlenül felbomlik az elektromos áram
hatására, miközben elemei szabaddá válnak;
javaslom, nevezzük ezeket elektrolitoknak [4]. ...
Végül javaslok egy terminust azon testek leírására,
amelyek képesek az elektródokhoz, vagy, ahogy általában
nevezik, a pólusokhoz vándorolni. Ezeket az anyagokat gyakran
elektropozitívnak,
illetve elektronegatívnak nevezik, attól függõen,
hogy a pozitív vagy a negatív pólus közvetlen
vonzásából feltételezhetõen következõ
befolyás alatt állnak-e.
E kifejezések azonban túlontúl jellegzetesek az
általam kívánt célra; azonkívül,
bár jelentésük helyes is lehet, de hipotetikusak lévén,
éppúgy hibás is; s ha így van, bár nagyon
csekély, de mégis igen veszélyes, mert folyamatos
hatásukkal nagy károkat okozhatnak a tudományban,
mivel behatárolják és korlátozzák mûvelõinek
szemléletét. Javaslom, hogy az ilyen testeket akként
különböztessük meg, hogy anionoknak [5] nevezzük
az anód, míg kationoknak [6] a katód
felé vándorlókat, és ha együttesen beszélünk
róluk, nevezzük õket ionoknak. Így például
az ólom-klorid elektrolit, s amikor ezt elektolizáljuk,
megjelenik a két ion, a klór, illetve az ólom
ionja, az elõbi kation, míg az utóbbi anion.
Remélem, hogy e jól definiált kifejezések
használata a késõbbiekben meg fog óvni a körülírásoktól
és a bizonytalanságtól. Mindazonáltal nem akarnám
túl gyakori használatukat erõltetni, csak amikor az
valóban szükséges, mivel meg vagyok gyõzõdve
róla, hogy a nevezéktan és a tudomány két
különbözõ dolog.
Világossá szeretném tenni, hogy a jelen okfejtés
során, eltérõen korábbi elõadásaimtól,
semmilyen feltételezéssel nem éltem az elektromos
áram természetére vonatkozóan; s bár
az áramról mint a pozitív részektõl
a negatív részek felé haladó folyamatról
beszéltem, ez csak a tudósok között szokásos,
bár jórészt hallgatólagos megegyezésnek
felelt meg, ami az áram erejének állandó, bizonyos
és határozott irányára vonatkozik. ...
A VOLTA-FÉLE ELEKTROMOSSÁG ÚJ MÉRÉSI
MÓDSZERE
Miként azt már a közönséges, illetve
a Volta-féle elektromsságnak közös mérési
standardra való visszavezetésével, illetve az elektrokémiai
bomlásra vonatkozó elméletem bevezetésekor
ismételten kifejtettem, az áram kémiai bontó
hatása állandó elektromosságmennyiség
esetén állandó, tekintet nélkül
az áramforrásban, az áram erõsségében,
a használt elektródok méretében, az áram
által átjárt vezetõk (ill. nemvezetõk)
természtében, illetve az egyéb körülményekben
meglévõ bármilyen nagy különbségekre.
A fenti állítások igazságának bizonyítékait
alább fogjuk taglalni.
Szándékom az volt, hogy a fenti törvényre
alapozva olyan eszközt szerkesszek, amely méri a rajta áthaladó
áram mennyiségét, s amely bármely kísérletnél
az áramkörbe kötve összehasonlító
standardként szolgálhat a hatás mérésére,
illetve ezen illékony tünemény pozitív mértékeként
mûködhet.
Közönséges körülmények között
nincs a víznél alkalmatosabb jelzõanyag egy ilyen
eszköz számára; ha egy nála jobb vezetõt,
például savat vagy sót adunk hozzá, készségesen
bomlik; elemei számos esetben minden másodlagos zavaró
körülmény nélkül kinyerhetõk és
összegyüjthetõk a rendszerbõl; s mivel gázalakúak,
a legjobb fizikai állapotban vannak az összegyûjtéshez,
illetve az elkülönítéshez. A fentiek miatt a továbbiakban
kénsavval savanyított vízzel végzett kísérleteimrõl
számolok be, habár bizonyos különleges estekben
más anyagok használata is célszerû lehet.
A mérõeszköz megszerkesztésénél
figyelemmel kell lenni arra, hogy elkerüljük a fejlõdõ
gázok rekombinációját, és a pozitív
elektródon tapasztalható zavaró hatásokat.
E célból a vízbontó berendezés számos
változatát használtuk.
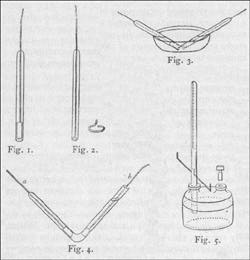 Az
elsõ berendezés egyenes csövekbõl áll;
ezek mindegyike arannyal összeforrasztott platinalemezt és
drótot tartalmaz, amelyek hermetikusan vannak rögzitve az üvegcsõ
zárt végébe (1. ábra). A csövek kb. 8
hüvelyk hosszúak, átmérõjük 0,7 hüvelyk,
és beosztással vannak ellátva. A platinalemez kb.
egy hüvelyk hosszú, olyan széles, amilyet az üvegcsõ
megenged, s a csõ szájához oly közel helyeztük
el, amennyire ez, a fejlõdõ gáz maradéktalan
összegyûjtését figyelembe véve, egyáltalán
lehetséges volt. Azon esetekben, amikor fontos, hogy az elemek a
lehetõ legkisebb felületen jelenjenek meg, az elektród
fémrésze lemez helyett gyûrû alakúra hajlított
fémhuzal is lehet (2. ábra). Amikor e csöveket mérésre
használjuk, hígított kénsavval töltjük
meg õket, majd egy ugyanilyen folyadékkal töltött
kádba merítjük (3. ábra), ferde helyzetben rögzítjük
õket, akként, hogy szájuk egymáshoz a lehetõ
legközelebb legyen, hogy a lehetõ legkevesebb bomlástermék
szökhessen csak el; egy másik elrendezés során
pedig a platinalemezeket függõleges helyzetben rögzítjük.
Az
elsõ berendezés egyenes csövekbõl áll;
ezek mindegyike arannyal összeforrasztott platinalemezt és
drótot tartalmaz, amelyek hermetikusan vannak rögzitve az üvegcsõ
zárt végébe (1. ábra). A csövek kb. 8
hüvelyk hosszúak, átmérõjük 0,7 hüvelyk,
és beosztással vannak ellátva. A platinalemez kb.
egy hüvelyk hosszú, olyan széles, amilyet az üvegcsõ
megenged, s a csõ szájához oly közel helyeztük
el, amennyire ez, a fejlõdõ gáz maradéktalan
összegyûjtését figyelembe véve, egyáltalán
lehetséges volt. Azon esetekben, amikor fontos, hogy az elemek a
lehetõ legkisebb felületen jelenjenek meg, az elektród
fémrésze lemez helyett gyûrû alakúra hajlított
fémhuzal is lehet (2. ábra). Amikor e csöveket mérésre
használjuk, hígított kénsavval töltjük
meg õket, majd egy ugyanilyen folyadékkal töltött
kádba merítjük (3. ábra), ferde helyzetben rögzítjük
õket, akként, hogy szájuk egymáshoz a lehetõ
legközelebb legyen, hogy a lehetõ legkevesebb bomlástermék
szökhessen csak el; egy másik elrendezés során
pedig a platinalemezeket függõleges helyzetben rögzítjük.
A berendezés egy másik formája a 4. ábrán
látható. Ez egy középen meghajlított,
egyik végén zárt csõ, melynek zárt végébe
egy a platinahuzal és lap van rögzítve, amely az ábrázolt
helyzetben a lehetõ legjobban lenyúlik a csõ könyöke
felé, lehetõvé téve az összes rajta fejlõdõ
gáz összegyûjtését a csõ zárt
végében. A platinalap itt is téglalap alakú.
A másik, b-vel jelölt fémelektródot csak a bontás
megkezdésekor helyezzük a csõbe, ugyancsak a lehetõ
legközelebb a könyökhöz, ügyelve azonban arra,
hogy az ezen fejlõdõ gázból – melyet hagyunk
elszállni – semmi se juthasson a zárt csõvégbe.
A berendezés harmadik megvalósítási formája
mindkét elektródot ugyanabban a csõben tartalmazza,
ezért itt az átalakulási, illetve bomlási folyamat
sokkal gyorsabb, mint az elkülönített csövek esetében.
A kapott gázmennyiség a két elektródon keletkezõ
gáz összege, és rendes körülmények
között ez a készülék az elõzõ
kettõnél jobban alkalmazható az áthaladt elektromosság
mennyiségének mérésére. A készülék
egy felsõ végén lezárt egyenes csõbõl
áll, amelybe, a csõ oldalfalán áthatoló
platinahuzalok segítségével két platinalap
van beforrasztva. E csõ csiszolattal csatlakozik egy kétnyakú
üvegedény egyik nyakához. A csövet akként
tölthetjük meg hígított kénsavval, hogy
a nagy edényt félig, illetve kétharmadig töltve
az egész berendezést megdöntjük, miáltal
a csõ megtelik folyadékkal. Ha a rendszeren elektromos áram
halad keresztül, a keletkezõ gázok összegyûlnek
a csõ felsõ végében, s így elkerülhetõ
a platinalemezeken való rekombinálódásuk. ...
[Faraday a továbbiakban részletesen leírja a kísérleteket.]
Úgy vélem, a fenti vizsgálatok elegendõ
bizonyítékot szolgáltattak a VÍZ esetében
arra a különleges és nagyon fontos elvre, hogy ha elektromos
áram hatásának tesszük ki, az ebomlott anyag
mennyisége pontosan arányos az áthaladt áram
mennyiségével, tekintet nélkül a fennállható
körülmények, illetve feltételek ezernyi változatára.
...
Jelenleg az itt leírt mérõeszköz az egyetlen,
amellyel a Volta-elektromosságot mérni tudjuk. Mivel az eredményeket
sem az idõben, sem az intenzitásban, vagy akár magában
az áramban bármi okból beálló bárminémû
változások sem befolyásolják, sõt még
a folyamat félbeszakítása sem, az eszköz mindig
pontosan rögzíti és méri az adott vizsgálat
során áthaladt elektromosság mennyiségét,
a mûszernek a VOLTA-ELEKTROMÉTER nevet adtam...

 A
bemutatott esetekben, az elsõ kivételével, a víz
inaktívnak tûnt, mégis, elkerülendõ a jelenlétébõl
következõ esetleges kétségeket, olyan anyagot
kerestem, amelybõl a víz teljesen hiányzik; s a már
ismert vezetési törvény [7] felhasználásával
számosat találtam is, melyek közül elsõként
az ón-protokloridot vetettem alá elektrolitikus bontásnak
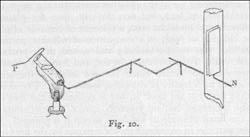
az alábbi módon. Egy platinahuzal egyik végét
kis gombbá csavartuk, a huzal súlyát pontosan lemértük,
majd hermetikusan egy üvegcsõ aljába forrasztottuk,
akként, hogy a gomb a csõ belsejébe essék (9.
ábra). A csövet úgy erõsítettük egy
platinadrót darabra, hogy borszeszégõvel melegíthessük.
A csövet félig töltöttük frissen olvasztott
ón-protokloriddal; a benne lévõ huzalt összekötöttük
egy volta-elektrométerrel, melynek másik sarkát egy
Volta-telep negatív pólusához csatlakoztattuk; egy
platinahuzalt pedig, amely ugyanezen telep pozitív pólusával
volt összekötve, belemerítettünk a csõben
lévõ olvadt kloridba. E huzalt úgy hajlítottuk
meg, hogy a csövet tartó kéz, illetve készülék
semmilyen mozgása esetén se érintkezhessen a csõben
lévõ negatív elektróddal. Az egész elrendezést
a 10. ábrán tüntettük fel.
A
bemutatott esetekben, az elsõ kivételével, a víz
inaktívnak tûnt, mégis, elkerülendõ a jelenlétébõl
következõ esetleges kétségeket, olyan anyagot
kerestem, amelybõl a víz teljesen hiányzik; s a már
ismert vezetési törvény [7] felhasználásával
számosat találtam is, melyek közül elsõként
az ón-protokloridot vetettem alá elektrolitikus bontásnak
az alábbi módon. Egy platinahuzal egyik végét
kis gombbá csavartuk, a huzal súlyát pontosan lemértük,
majd hermetikusan egy üvegcsõ aljába forrasztottuk,
akként, hogy a gomb a csõ belsejébe essék (9.
ábra). A csövet úgy erõsítettük egy
platinadrót darabra, hogy borszeszégõvel melegíthessük.
A csövet félig töltöttük frissen olvasztott
ón-protokloriddal; a benne lévõ huzalt összekötöttük
egy volta-elektrométerrel, melynek másik sarkát egy
Volta-telep negatív pólusához csatlakoztattuk; egy
platinahuzalt pedig, amely ugyanezen telep pozitív pólusával
volt összekötve, belemerítettünk a csõben
lévõ olvadt kloridba. E huzalt úgy hajlítottuk
meg, hogy a csövet tartó kéz, illetve készülék
semmilyen mozgása esetén se érintkezhessen a csõben
lévõ negatív elektróddal. Az egész elrendezést
a 10. ábrán tüntettük fel.
A fenteb leírt körülmények között
a klorid elbomlik; a pozitív elektródon klór fejlôdik,
ami ón-bikloridot alkotva elgõzölõg; a negatív
elektródon kiváló ón pedig ötvözetet
alkot a platinával, amely ötvözet az alkalmazott hõmérsékleten
olvadt állapotban van, így kizárt a bomló anyagon
keresztüli véletlen fémes kontaktus lehetõsége.
A kísérletet addig folytattuk, míg a Volta-elektrométerben
jelentõs mennyiségû gáz gyûlt össze,
ekkor megszakítottuk az áramkört, eltávolítottuk
a pozitív elektródot, s a csövet a maradék kloriddal
hagytuk lehûlni. Lehûlés után a csövet összetörve
a maradék klorid, illetve az üveg könnyen elválasztható
volt az ötvözet-gombban végzõdõ platinahuzaltól.
Az utóbbit megmostuk, majd ismét lemértük, s
a súlynövekedés megadta a kivált ón mennyiségét.
Alább megadom az egyik kísérlet részeredményeit,
bemutatva azt a számítási módszert, melyet
a többi idézett vizsgálatnál is alkalmaztam.
A negatív elektród kezdetben 20 granumot nyomott [1
granum = 64,8 mg], a kísérlet befejezése után
az ötvözet-gombbal mért együttes tömege 23,2
granum volt. Így tehát az elektromos áram által
a katódon kiválasztott ón tömege 3,2 granum.
A Volta-elektrométerben 3,85 köbhüvelyk hidrogén
és oxigén gyûlt össze. 100 köbhüvelyk
oxigén és hidrogén a víznek megfelelõ
arányban 12,92 granumot nyom, a fenti mennyiség súlya
tehát 0,49742 granum lehet, ebbõl következik, hogy ennyi
a súlya annak a víznek, amelyet épp annyi elektromos
áram bont elemeire, amely az ón-protoklorid bomlása
során 3,2 granum fémet választott ki. Ebbõl
0,49742 : 3,2 = 9 (a víz egyenértéke) : az ón
egyenértéke, mely utóbbi 57,9-nek adódik, feltéve,
hogy a kísérletet hibátlanul végeztük,
s ha az elektrokémiai bomlás ez esetben is határozott
volt. Egyes kémiai munkák 58-at adnak meg az ón
egyenértékére, míg mások 57,9-et. Mindkettõ
igen közel van kísérletünk eredményéhez,
úgyhogy figyelembe véve a kísérlet során
elõadódható apró eltéréseket
(pl a Volta-elektrométerben lehetséges gázadszorpciót)
a számok csekély kétséget hagynak a határozott
hatás törvényének alkalmazhatósága
felõl az elektromos bomlás ilyen és ehhez hasonló
eseteiben.
Munkám során csak ritkán tapasztaltam a számoknak
a fentihez hasonlóan közeli egyezését. Négy
kísérletet végeztünk az ón-protokloriddal;
a Volta-elektrométerben mért gázmennyiségek
2,05-tõl 10,29 köbhüvelykig terjedtek. A négy vizsgálat
átlaga 58,43 volt az ón elktrokémiai egyenértékére.
A kísérletben visszamaradt klorid tiszta ón-protoklorid
volt, és senki sem kételkedhet abban, hogy a kivált
ónnal ekvivalens mennyiségû klór fejlõdött
az anódon, amely másodlagosan ón-bikloriddá
alakulva elpárolgott.
Az ólom-kloriddal is végeztünk az elõzõvel
majdnem pontosan azonos módon kísérletet, a különbség
mindössze a pozitív elektród természetében
volt. Az anódon fejlõdõ klór nem képez
ólom-perkloridot, hanem platina használata esetén
azzal közvetlenül platina-kloridot alkot, amelynek oldata az
ólom-klorid-oldatba kerülve azt eredményezné,
hogy bizonyos platinamennyiség átkerülne a katódra,
meghamisítva ezzel a kísérleti eredményeket.
Ezért új anyagot kerestem, és megtaláltam a
grafitot, amelyet biztonsággal lehet pozitiv elektródként
alkalmazni kloridok, jodidok stb. esetében. A klór vagy a
jód nincs rá hatással, hanem szabad állapotban
válik ki a felületén; nem reagál az olvadt kloridddal
vagy jodiddal sem, amelybe belemerül. Még ha a mechanikus igénybevételtõl
vagy a gázfejlõdéstõl le is válik néhány
grafitdarabka az elektród felületérõl, ezek semmi
problémát nem okoznak.
Három kísérlet átlagából 100,85
adódott az ólom egyenértékére. A kémiai
egyenérték 103,5. A hiány véleményem
szerint a gáz egy részének a Volta-elektrométerben
való feloldódásából származik,
azonban az eredmények szerintem nem hagynak kétséget
afelõl, hogy úgy az ólom, mind a klór ez esetben
is meghatározott mennyiségben szabadul fel adott mennyiségû
elektromosság hatására.
Gács János fordítása
Megjegyzések
0. [Faraday nem használt ilyen lábjegyzeteket, az 1–6
jegyzetben az általa használt görög szavakat adjuk
meg:]

7. [A hivatkozott törvény ezt állítja: "általánosan
feltehetõ a testek vezetõvé válása,
amint szilárd állapotból folyadék állapotba
kerülnek".]
ChemoNet, 1997
Vissza |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |
 Az
elsõ berendezés egyenes csövekbõl áll;
ezek mindegyike arannyal összeforrasztott platinalemezt és
drótot tartalmaz, amelyek hermetikusan vannak rögzitve az üvegcsõ
zárt végébe (1. ábra). A csövek kb. 8
hüvelyk hosszúak, átmérõjük 0,7 hüvelyk,
és beosztással vannak ellátva. A platinalemez kb.
egy hüvelyk hosszú, olyan széles, amilyet az üvegcsõ
megenged, s a csõ szájához oly közel helyeztük
el, amennyire ez, a fejlõdõ gáz maradéktalan
összegyûjtését figyelembe véve, egyáltalán
lehetséges volt. Azon esetekben, amikor fontos, hogy az elemek a
lehetõ legkisebb felületen jelenjenek meg, az elektród
fémrésze lemez helyett gyûrû alakúra hajlított
fémhuzal is lehet (2. ábra). Amikor e csöveket mérésre
használjuk, hígított kénsavval töltjük
meg õket, majd egy ugyanilyen folyadékkal töltött
kádba merítjük (3. ábra), ferde helyzetben rögzítjük
õket, akként, hogy szájuk egymáshoz a lehetõ
legközelebb legyen, hogy a lehetõ legkevesebb bomlástermék
szökhessen csak el; egy másik elrendezés során
pedig a platinalemezeket függõleges helyzetben rögzítjük.
Az
elsõ berendezés egyenes csövekbõl áll;
ezek mindegyike arannyal összeforrasztott platinalemezt és
drótot tartalmaz, amelyek hermetikusan vannak rögzitve az üvegcsõ
zárt végébe (1. ábra). A csövek kb. 8
hüvelyk hosszúak, átmérõjük 0,7 hüvelyk,
és beosztással vannak ellátva. A platinalemez kb.
egy hüvelyk hosszú, olyan széles, amilyet az üvegcsõ
megenged, s a csõ szájához oly közel helyeztük
el, amennyire ez, a fejlõdõ gáz maradéktalan
összegyûjtését figyelembe véve, egyáltalán
lehetséges volt. Azon esetekben, amikor fontos, hogy az elemek a
lehetõ legkisebb felületen jelenjenek meg, az elektród
fémrésze lemez helyett gyûrû alakúra hajlított
fémhuzal is lehet (2. ábra). Amikor e csöveket mérésre
használjuk, hígított kénsavval töltjük
meg õket, majd egy ugyanilyen folyadékkal töltött
kádba merítjük (3. ábra), ferde helyzetben rögzítjük
õket, akként, hogy szájuk egymáshoz a lehetõ
legközelebb legyen, hogy a lehetõ legkevesebb bomlástermék
szökhessen csak el; egy másik elrendezés során
pedig a platinalemezeket függõleges helyzetben rögzítjük.

 A
bemutatott esetekben, az elsõ kivételével, a víz
inaktívnak tûnt, mégis, elkerülendõ a jelenlétébõl
következõ esetleges kétségeket, olyan anyagot
kerestem, amelybõl a víz teljesen hiányzik; s a már
ismert vezetési törvény [7] felhasználásával
számosat találtam is, melyek közül elsõként
az ón-protokloridot vetettem alá elektrolitikus bontásnak
az alábbi módon. Egy platinahuzal egyik végét
kis gombbá csavartuk, a huzal súlyát pontosan lemértük,
majd hermetikusan egy üvegcsõ aljába forrasztottuk,
akként, hogy a gomb a csõ belsejébe essék (9.
ábra). A csövet úgy erõsítettük egy
platinadrót darabra, hogy borszeszégõvel melegíthessük.
A csövet félig töltöttük frissen olvasztott
ón-protokloriddal; a benne lévõ huzalt összekötöttük
egy volta-elektrométerrel, melynek másik sarkát egy
Volta-telep negatív pólusához csatlakoztattuk; egy
platinahuzalt pedig, amely ugyanezen telep pozitív pólusával
volt összekötve, belemerítettünk a csõben
lévõ olvadt kloridba. E huzalt úgy hajlítottuk
meg, hogy a csövet tartó kéz, illetve készülék
semmilyen mozgása esetén se érintkezhessen a csõben
lévõ negatív elektróddal. Az egész elrendezést
a 10. ábrán tüntettük fel.
A
bemutatott esetekben, az elsõ kivételével, a víz
inaktívnak tûnt, mégis, elkerülendõ a jelenlétébõl
következõ esetleges kétségeket, olyan anyagot
kerestem, amelybõl a víz teljesen hiányzik; s a már
ismert vezetési törvény [7] felhasználásával
számosat találtam is, melyek közül elsõként
az ón-protokloridot vetettem alá elektrolitikus bontásnak
az alábbi módon. Egy platinahuzal egyik végét
kis gombbá csavartuk, a huzal súlyát pontosan lemértük,
majd hermetikusan egy üvegcsõ aljába forrasztottuk,
akként, hogy a gomb a csõ belsejébe essék (9.
ábra). A csövet úgy erõsítettük egy
platinadrót darabra, hogy borszeszégõvel melegíthessük.
A csövet félig töltöttük frissen olvasztott
ón-protokloriddal; a benne lévõ huzalt összekötöttük
egy volta-elektrométerrel, melynek másik sarkát egy
Volta-telep negatív pólusához csatlakoztattuk; egy
platinahuzalt pedig, amely ugyanezen telep pozitív pólusával
volt összekötve, belemerítettünk a csõben
lévõ olvadt kloridba. E huzalt úgy hajlítottuk
meg, hogy a csövet tartó kéz, illetve készülék
semmilyen mozgása esetén se érintkezhessen a csõben
lévõ negatív elektróddal. Az egész elrendezést
a 10. ábrán tüntettük fel.
