![]()
A folyadékok felületi feszültsége és vegyi alkata között fennálló kapcsolatról
Mathematikai és Természettudományi Értesítõ,
1885.
54–61. o.
Mathematische und naturwissenschaftliche Berichte aus Ungarn, 1886.
33–44. o.
in: Eötvös Loránd tudományos és mûvelõdéspolitikai írásaiból, válogatta Bodó Barba, Kriterion, Bukarest, 1980
Körülbelöl tíz évvel ezelôtt egy módszert gondoltam ki a kapillaritási állandó megfigyelésére, mely lehetôvé tette a nyugvó folyadékok felületének teljes kiterjedésükben való vizsgálatát, és mely nekem ezért a kapillaritás-elmélet eredményeinek vizsgálatára különösen alkalmasnak látszott. Az utóbbi volt tulajdonképpen a cél, amire eredetileg törekedtem, de nemsokára vizsgálódásaim területe kibôvült: az elektrokapillaritás jelensége, az úgynevezett hatósugár kérdése merültek fel akaratlanul, és részben meg is oldódtak.
Közben sikerült a folyadékok felületi feszültségét tetszés szerinti idôtartamon át változatlanul tartanom, úgyhogy valódi értékeit biztosan meg tudtam állapítani. Ennek a legfôbb akadálynak az eltávolítása után, kiváltképpen Van der Waals úr kutatásai által ösztönözve, neki tudtam merészkedni e terület legfontosabb kérdésének, nevezetesen annak, hogy tanulmányozzam a felületi feszültség összefüggését a folyadék vegyi összetételével.
Habár eddigi kutatásaim legfontosabb eredményeit
idôrôl idôre rövid közlemények formájában
a Magyar Tudományos Akadémiának elôterjesztettem,
mégis halogattam ezek részletes közlését,
mert minden új eredmény újabb feladatokat is állított,
melyeknek a megoldása számomra szintén kívánatosnak
tûnt. Azonban a testek fizikai és kémiai tulajdonságai
közötti összefüggésre vonatkozó összes
kérdések iránti érdeklôdés, mely
az utóbbi idôben egy sor gondos dolgozatot eredményezett,
arra ösztönöz, hogy kutatásaim azon részét,
mely kapcsolatban van ezzel a kérdéssel, kivonatban közöljem.
Kutatásaimnak egy teljesebb kidolgozása késôbb
kell következzék.
I. Új módszer a kapillaritási állandó meghatározására
A kapillaritási állandó meghatározására 1875 óta használok egy módszert, melyet reflexiós módszernek fogok nevezni. Ez lényegében a következôkbôl áll. A folyadék FF felületére az S1 és S2 fényforrásokból kiinduló két sugárnyaláb, az S1J1 és S2J2 esik, amelyek ezen visszaverôdve egy katetométer vízszintesen beállított távcsövébe jutnak. A távcsô látómezejében két vízszintes fénycsík jelenik majd meg, amelyek az egyik, illetve a másik beesô fénynyalábból származó sugarakat vízszintes irányba verik vissza. A felület hajlását a J1 és J2 pontokban meghatározhatjuk a beesô sugarak irányából a mértani reflexiós törvény segítségével. Ezen pontok függôlegesen mért J1P távolságát katetométerrel mérjük meg. Ezen, megfigyelés útján meghatározott mennyiségek segítségével, az elmélet által az illetô felületre megadott egyenletekbôl kiszámítható a kapillaritási állandó.
Magyarázatul szolgáljon a kapilláris hengerfelület példája, melyet egy folyadék egy nagyobb edény sík oldalfala mentén hoz létre. Az elmélet erre a következô egyenletet adja:
![]()
ahol a a kapillaritási állandó négyzetgyökét, z a nívófelülettôl lefelé mért függôleges ordinátáját jelöli, q pedig azt a szöget, melyet a felület normálisa a függôlegessel bezár. Ha z1,q1 és z2,q2-vel jelöljük a felület két pontjában ezeket a mennyiségeket, akkor a-ra a kövétkezô egyenletet kapjuk:
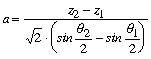
ahol a z2–z1, valamint a q2 és q1 értékeket is mérésekkel határozzuk meg.
Ezt az itt röviden körvonalazott módszert használtam mind a kapilláris hengerfelületek, mind a forgásfelületek esetében. A körülményektôl függôen a beesô sugarak irányát úgy választottam meg, hogy azok a folyadékon kívül vagy a folyadékban belül jussanak a felületre. A forgásfelületek esetében, amilyen a viszonylag kis átmérôjû csöveknél (körülbelöl 5–20 mm) keletkezik, ahol elmélet adta képlet nem áll rendelkezésünkre, az a mennyiséget olyan folyadékok segítségével, melyek kapillaritási állandóját már ismertem, összehasonlító mérésekkel határoztam meg.
Ezt a módszert egyes különleges vizsgálatokra megváltoztattam oly módon, hogy a katetométer helyett egy vízszintesen elmozdítható függôleges távcsövet használtam, és ezzel a két pont közötti vízszintes távolságot mérve, ezt az a állandó kiszámítására használtam.
Ennek a módszernek az elônyei a következôk:
1. Független az érintkezési szöget illetô
bármilyen feltételezéstôl, akárcsak a
szilárd edényfalak nedvesítésének jellegétôl
is.
2. Ugyanennek a segítségével olyan folyadékokra
is végezhettem méréseket, melyek lezárt üvegedényben,
csak saját gôzeikkel érintkeznek. Ezáltal értem
el a felületi feszültségnek egy alig sejtett állandóját,
miáltal a kapilláris jelenségek megfigyelésének
legnagyobb akadálya hárult el. A víz felületén
végzett mérések ebben az edényben ugyanazon
a hômérsékleten a kapilláris állandóra
évek múltán is ugyanazt az értéket adták.
3. Ez a módszer lehetôvé tette a kapillaritási
állandó változásának a figyelemmel követését
olyan hômérsékleteken is, amelyek jóval felette
vannak a folyadék forrpontjának, így például
alkohol esetében 236 oC-ig, etiléter esetében
190 oC-ig. Ugyancsak lehetséges volt cseppfolyósodott
gázok kapillaritási állandóját, így
a szénsavét, a kénsavét és másokét
meghatározni.
4. Az így nyert eredmények összehasonlítása
a kapilláris csövek emelkedési magasságának
megfigyelésébôl származókkal, felvilágosítást
nyújtanak az illeszkedési szög nagyságát
illetôen.
II. Elméleti tárgyalás
A különbözô testek fizikai és kémiai tulajdonságai az eddig több ízben megkísérlett módon, ti. ugyanazon, éspedig önkényesen választott hômérsékletek mellett nem hasonlíthatók össze, hanem csakis olyan különbözô hômérsékleteknél, melyek az összehasonlítandó testek mindegyikére a reája vonatkozó adatokból egyenkint meghatározandók.
Az összehasonlításnál követendô eljárást Van der Waals mutatta meg. A testeket ugyanis megfelelô állapotban, vagyis olyan abszolút hômérsékleteknél hasonlítja össze, melyek abszolút kritikus temperatúrájuknak egyenlô részeit teszik. Ámde a kritikus temperatúrák az ilyen vizsgálatoknál igen bizonytalan kiindulót képeznek, amennyiben nemcsak hogy nehezen határozhatók meg a megkívántató pontossággal, hanem még annak lehetôsége sincsen kizárva – sôt ellenkezõleg, egyes esetekben több mint valószinû –, hogy a test ennél a magas hômérsékletnél vegyi disszociációt szenved.
Eme nehézségeket kikerülendô, a megfelelô állapotnak másféle definícióját vettem alapul. Ugyanis részben (csepp)folyós, részben pedig telített gôzállapotban levô, vegyileg homogén testet egyenlô tömegû molekulákból álló rendszernek tekintve, ennek állapota molekuláinak térbeli elosztásmódjával jellemezhetô. Jelöljük tehát v-vel a folyadék molekulártérfogatát, vagyis annak a térnek átlagos értékét, melyet a molekula a folyadékban elfoglal, u-val pedig ugyanezt az adatot a telített gôzre vonatkozólag; akkor a v/u viszony a test állapotának jellemzésére alapul szolgálhat. Ha mármost ez a viszony két testre nézve a megfelelô T1 és T2 hômérsékletek mellett ugyanazon értékû, akkor a testek molekuláiból hasonló módon vannak összetéve. A hasonló összetétel ilyen állapotában a két testre
![]()
egyenlet érvényes, és a gáztérfogatokra vonatkozó tételek következtében
![]()
hol p1 és p2 a két test telített gôzeinek nyomását jelentik T1 és T2 hômérsékleteknél. Ezekbôl az egyenletekbôl kitetszik, hogy ekkor a testek a Van der Waals-féle definíció értelmében is megfelelô állapotban vannak.
Már most megkísérlettem egy bizonyos feltevésbôl következtetéseket vonni, abból a feltevésbôl ti., hogy a megfelelô állapotban, tehát a hasonló összetétel állapotában levô testek mechanikai értelemben is, azaz a megfelelô részeik között mûködô erôket és energiájukat illetôleg is hasonlók.
Ugyanis valamely folyadék felületének részét véve tekintetbe, melyet n molekula borít, a gõztôl reája gyakorolt nyomóerô
![]()
Másrészt a felületi feszültségnek megfelelô erô egy olyan vonal mentén, melyben m molekula sorakozik,
![]()
mely kifejezésben a1 a felületi feszültséget, vagyis a hosszegységre vonatkozó energiát jelenti.
Képezzük ugyanezeket a kifejezéseket egy másik testnek ugyanazon számú molekulákból alkotott megfelelô részeire, ezek nyilván
![]() és
és ![]()
Feltevésünkbôl az következik, hogy megfelelõ állapotokra vonatkozólag
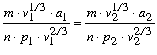
mibôl
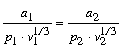
Hasonló okoskodást alkalmazva a megfelelô részek energiájára, a megegyezô állapotokra a következô kifejezést nyerjük:
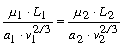
hol m1 és m2 a molekulár súlyokat, L1 és L2 pedig a gôzök lappangó hôit jelentik.
Eme tételek levezetésénél feltételeztem, hogy a folyadék és a gáz molekulái egyenlõ tömegûek. Azokat a folyadékokat, melyekre ez csakugyan áll, röviden összetetteknek fogom nevezni. Ezt az elnevezést behozva, az elôbb nyert tételek következôleg fogalmazhatók össze:
Ha bármilyen két egyszerûen összetett folyadékra
T1 és T2 abszolút hômérsékleteik
mellett
| (1) |
egyenlet áll, úgy ugyanezen hômérsékletek
mellett még
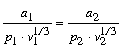 |
(2) |
és
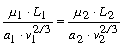 |
(3) |
egyenletek is érvényesek, továbbá (1)
és (2)-bôl
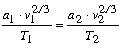 |
(4) |
és
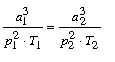 |
(5) |
A (3) alatti egyenlet egy tételt tartalmaz, melyet Waterston már 1858-ban, ámbár tökéletlenül – ti. tetszôleges hômérsékletekre – kimondott. Van der Waals is két erre vonatkozó tételt állított fel, melyek egyike az (5) egyenletben kifejezettôl csak annyiban különbözik, amennyiben abban a nyomás és a hômérséklet a kritikus állapotra van vonatkoztatva. Ez az utóbbi körülmény magyarázza meg, hogy miért nem sikerült e tétel helyességét igazolnia.
Ezáltal tévútra vezetve, eleinte én magam
is más, a tapasztalatokkal jobban egyezô összefüggést
kerestem. A Magyar Tudományos Akadémiának 1885 elején
benyújtott értekezésemben mint tapasztalati
tételt mondtam ki azt, hogy a megfelelô hômérsékleteknél
pT2/a3 kifejezés értéke különbözô
anyagokra vonatkozólag megegyezik. E tételnek különösen
vízre és az alkoholra vonatkozó értékei
tényleg sokkal jobban megfelelnek. Elméleti tárgyalásaim
jelenleg arra
indítanak, hogy a tételt visszavonjam, s utóbb
ki fogom mutatni, mi okozza a víz és az alkohol sajátszerû
magaviseletét.
A fönt levezetett összefüggésekbôl, nevezetesen a (4) egyenletben foglaltakból további következtetéseket is vontam, melyek a molekulártérfogat és a felületi feszültség között fennálló szoros és egyszerû kapcsolatot még világosabban feltüntetik.
Van der Waals okoskodásai szerint a test, mely T1 és T2 abszolút hômérsékletek alatt megegyezô állapotban van, ugyancsak megegyezô állapotokba jut, ha hômérsékleteik változása T1 s illetôleg T2-vel arányos. Megegyezô állapotokra tehát a (4) egyenlet értelmében
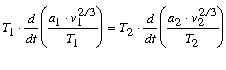
mibôl
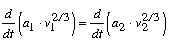 |
(6) |
következik. Ennek a hányadosnak értékét etiléterre vonatkozólag 0 oC-tól 190 oC közé esõ hõmérsékleti körben gondosan meghatároztam, s a hõmérséklettel való változást kimutatnom nem sikerült. Ámde ha ez egy testre áll, a (6) egyenlet folytán a megfelelõ hõmérsékleti határok között valamennyi más testre is ugyanannak kell állnia. Más testeken végzett megfigyelések kimutatták, hogy e hányadosok még tágabb hõmérsékleti határok között is állandók.
E szerint a következõ tételre jutottunk: A 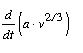 hányados
valmennyi egyszerûen összetett folyadékra állandó
értékkel bír, mely a hômérséklettôl
független, éspedig legalábbis abban a hômérsékleti
körben, mely az abszolút nullpont és a kritikus temperatúra
középhômérsékleténél magasabb.
Állandóságról itt természetesen csak
annyiban van szó, amennyiben az eddigi megfigyeléseim pontossága
mellett megállapítható; nincs kizárva az az
eset, hogy még pontosabb megfigyelések, nevezetesen a tágabb
hômérsékleti határok között végzendô
mérések ezen értéknek a hômérséklettôl
való függését fogják kimutatni.
hányados
valmennyi egyszerûen összetett folyadékra állandó
értékkel bír, mely a hômérséklettôl
független, éspedig legalábbis abban a hômérsékleti
körben, mely az abszolút nullpont és a kritikus temperatúra
középhômérsékleténél magasabb.
Állandóságról itt természetesen csak
annyiban van szó, amennyiben az eddigi megfigyeléseim pontossága
mellett megállapítható; nincs kizárva az az
eset, hogy még pontosabb megfigyelések, nevezetesen a tágabb
hômérsékleti határok között végzendô
mérések ezen értéknek a hômérséklettôl
való függését fogják kimutatni.
Az állandó értéke gyanánt, mint alább terjedelmesebben elôadom, 0,227-et nyertem. Ennek kiszámításánál v molekulártérfogatnak a molekulársúly és a sûrûség viszonyát vettem, s a felületi feszültség egységéül azt választottam, mely a folyadék felületében 1 mm-nyi hosszon a milligramm súlyával egyenlô erôt fejt ki. Ennek folytán
![]()
is írható, hol t azt a hômérsékletet
jelenti, mely alatt a w2/3 zérussal
egyenlô. Megfigyeléseim, melyeket éter-, alkohol-,
szénsav- és más folyadékokon végeztem,
arra látszanak mutatni, hogy ez a hômérséklet
a kritikus temperatúrával megegyezik, vagy legalább
nem messze esik tôle.
III. Kísérleti igazolások
A felsorolt tételek kísérleti igazolására igen gazdag anyag állott rendelkezésemre; nevezetesen 160 különbözô, részint szerves, részint pedig szervetlen anyagon végzett megfigyelések. Magam már régebben közzétett módszerem segélyével a folyadékok egész sorozatán meghatároztam a felületi feszültség értékét, s ezek között néhány cseppfolyósított gázét is; ezeken kívül R. Schiffnek a kapillaritási állandóra vonatkozó két értekezésében közölt eredményeit is felhasználtam. Ez utóbbiakat saját megfigyeléseimmel összehasonlítva, csak igen csekély eltéréseket találtam.
Az elsô kérdés az volt, hogy vajon a megfigyelések az olyan hômérsékletek alatt, melyeknél (2) alatti egyenlet áll, egyúttal a (3), (4), (5) és (6) egyenletek helyességét bizonyítják-e? A megegyezés néhány test, nevezetesen a víz, az alkoholok és a szénsavak kivételével, kielégítônek bizonyult; a felületi feszültséget a saját megfigyeléseimbôl, valamint R. Schiff elsô értekezésében* foglalt adatokból számítva, az eltérések az értéknek legfönnebb 5 százalékát érik el.
Ugyanezen szerzônek második értekezésébôl**
vett adatok valamivel nagyobb eltéréseket mutatnak, mi könnyen
megmagyarázható, minthogy ebben a kapillaritási állandó
értékei a forrpontra vonatkozólag empirikus képletek
segélyével, extrapoláció útján
számíttattak ki.
Elmléleti fejtegtéseim fôeredmánye hasonlóképpen
igaznak bizonyult. A 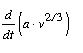 hányados
értékét gondosan meghatározva, a többi
között a következõ adatokat nyertem:
hányados
értékét gondosan meghatározva, a többi
között a következõ adatokat nyertem:
| Etiléter | 6 oC-tól 62 oC-ig | 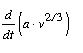 |
= 0,228 |
| Etiléter | 62 oC-tól 120 oC-ig | " | = 0,226 |
| Etiléter | 120 oC-tól 190 oC-ig | " | = 0,221 |
| Etilbromid | 20 oC-tól 99 oC-ig | " | = 0,227 |
| Etilbromid | 99 oC-tól 213 oC-ig | " | = 0,232 |
| Kloroform | 20 oC-tól 60 oC-ig | " | = 0,230 |
| Higanymetil | 20 oC-tól 99 oC-ig | " | = 0,228 |
| Szénoxiklorid | 3 oC-tól 63 oC-ig | " | = 0,231 |
| Széndioxid | 3 oC-tól 31 oC-ig | " | = 0,228 |
| Széndiszulfid | 22 oC-tól 78 oC-ig | " | = 0,237 |
| Kénessav | 2 oC-tól 60 oC-ig | " | = 0,230 |
R. Schiff megfigyeléseinek adataiból számított értékek ezektôl 0,02-nél többel nem térnek el.
A fönt említett testek, név szerint a víz, az alkoholok és a szénsavak kivételt képeznek. Ezeket tüzetesebb vizsgálatnak vetettem alá; viselkedésük elméleti okoskodás útján azon feltevés segélyével fejthetô meg, hogy az illetô testek a vizsgálat alá esô hômérsékleti térben nem egyszerûen összetettek, azazhogy molekuláik cseppfolyós állapotban nem ugyanazon tömeggel bírnak, mint gôzállapotban. Ez vagy úgy lehetséges, hogy a folyadék olyan egyenlô molekulákból áll, melyek a gôzt alkotó molekulák egyenlô sokszorosai, vagy pedig hogy a folyadék olyan különféle molekulák keveréke, melyek a gôzmolekulák különbözô sokszorosai. Ámde ha valamely folyadéknál az elsô eset áll, elôrelátható, hogy más hômérsékleti körbe való átmenetnél a második esetnek kell bekövetkeznie. Ha ti. az ilyen folyadék kritikus hômérsékletig hevíttetik, a folyadék molekuláinak okvetlenül gôzmolekulákká kell átalakulniuk, mivel hiszen ennél a hômérsékletnél egymással egyenlôkké válnak.
A fizikai szétbomlás eme neménél, mely a vegyi disszociációtól jól megkülönböztetendô, még mindig lehetséges, hogy a folyadék összetett molekulái nagyobb hômérsékleti körön belül változatlanok maradnak, vagy pedig hogy szétbomlásuk hirtelen, talán éppen a kritikus temperatúránál megy végbe.
Az etilalkohol viselkedését vettem vizsgálat alá,
éspedig egészen a kritikus hômérsékletig,
s a következô eredményekre jutottam:
| 21 oC-tól 78 oC-ig | 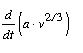 |
= 0,104 |
| 78 oC-tól 180 oC-ig | " | = 0,136 |
| 108 oC-tól 138 oC-ig | " | = 0,159 |
| 138 oC-tól 168 oC-ig | " | = 0,183 |
| 168 oC-tól 199 oC-ig | " | = 0,202 |
| 199 oC-tól 236 oC-ig | " | = 0,226 |
E számok amellett látszanak tanúskodni, hogy eme folyadék molekulái alacsony hômérsékletnél összetettek, melegítés közben pedig folytonosan végbemenô bomlást szenvednek, mely bomlás 200 oC hômérséklet alatt véget ér, mivel ettôl a hômérséklettôl kezdve a hányados a gôzsûrûségbôl kiszámított molekulársúlynak normális értékét veszi fel.
A vízre vonatkozólag feltûnôen kicsiny értékek
adódnak ki, ha számítás alapjául a H2O
képletet vesszük, tehát próbaképpen úgy
számítottam a hányados értékét,
hogy kettõs molekulákat tételeztem fel, s a következô
eredményeket találtam:
| 3 oC-tól 40 oC-ig | 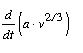 |
= 0,159 |
| 40 oC-tól 100 oC-ig | " | = 0,180 |
| 100 oC-tól 150 oC-ig | " | = 0,228 |
| 150 oC-tól 210 oC-ig | " | = 0,227 |
Ennek értelmében a cseppfolyós víz molekulái 100 és 210 oC között a gáz kettõs molekuláival lenének egyenlõk, alacsonaybb hõmérsékletek alatt azonban még nagyobbak.
A 210 oC-t meghaladó hõmérsékletek mellett eddig még nem tehettem megfigyeléseket, mivel a víz ezen hõmérsékleteknél az azt elzáró üvegedény falait megtámadja.
A zsírsavak sorából különösen az
ecetsavat vizsgáltam, és a C2H4O4
képlet alapján a következõ értékeket
nyertem:
| 21 oC-tól 107 oC-ig | 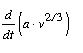 |
= 0,132 |
| 107 oC-tól 160 oC-ig | " | = 0,132 |
| 160 oC-tól 230 oC-ig | " | = 0,138 |
De ha 2 C2H4O4 képletet tesszük számításaink alapjává, a hányados értéke 0,211 lesz. Úgy látszik tehát, hogy az ecetsav molekulái ezen második képletnek felelnek meg, amit annak anomális gázsûrûsége csakugyan valószínûnek tüntet fel.
Még fölemlítem, hogy a higanyon is tettem méréseket, mégpedig 0 oC és 300 oC közé esô térben, s a hányados értékéül 0,18-at nyertem. Emellett azonban megjegyzendô, hogy itt a higany olyan hômérsékleti határok között vétetett megfigyelés alá, melyek kívül esnek ama határokon, melyek között tételemet érvényesnek mondtam ki.
Éter és széndiszulfid keveréket is tettem
megfigyeléseim tárgyává, s azt tapasztaltam,
hogy tételemet ezek is igazolják; molekulártérfogatul
ez esetben ![]() középértéket vettem, hol v1,
v2
az egyes molekulártérfogatokat, k pedig a keverési
viszonyt jelenti.
középértéket vettem, hol v1,
v2
az egyes molekulártérfogatokat, k pedig a keverési
viszonyt jelenti.
* Ueber die Capillaritätsconstanten der Flüssigkeiten bei
ihrem Siedepunkte (Liebig's Ann. 1864, pag. 223 – Wied. Beibl. VIII.
457–461).
** R. Schiff: Ueber die Capillaritätsaequivalente der einfachen
Körper (Wied. Beibl. 559–563).
| Kémiatörténet | http://www.chemonet.hu/
http://www.kfki.hu/chemonet/ |