Hollósi Miklós
az MTA rendes tagja
Eötvös Loránd Tudományegyetem
Természettudományi Kar
Szerves Kémiai Tanszék
2004
Az optikai aktivitás jelensége közel 200 éve ismert. Francia fizikusok (Malus 1809; Arago 1811; Biot 1812, 1815) megfigyelték, hogy a síkban polarizált fény bizonyos kristályokon vagy szerves molekulák oldatán áthaladva változást szenved. A polarizációs sík – az a sík, ahol a rezgések történnek – elfordul. Pasteur 1848-ban a jelenséget összekapcsolta a szerkezet disszimmetriájával. A kvarc enantiomorf (görögül enantios ellentétes, morphe pedig alak, forma) kristályai ugyanúgy tükörképi viszonyban vannak, mint a borkősavból nyerhető Na-NH4-tartarát ellentétes forgatású kristályai (1. ábra). A poláros fény polarizációs síkját az egyik módosulat jobbra, a másik módosulat pedig balra forgatja el. És ami nagyon fontos: az optikailag aktív kristályoknak nincs tükörsíkjuk, ugyanúgy, ahogy a jobb vagy bal kezünknek sem. Nem igényel további magyarázatot, hogy az optikai aktivitás jelensége szoros kapcsolatban van a szimmetriával.
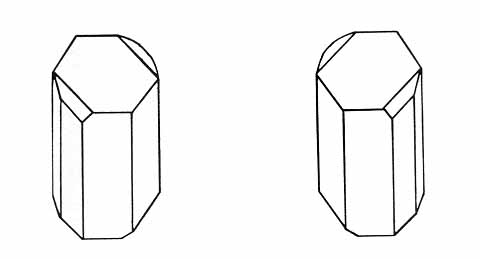
1. ábra. Tükörképi kristályok
Az ember külső megjelenését tekintve nagyjából tükörszimmetrikus. Belső szerveink elrendeződése azonban már nem az. Szívünk és gyomrunk baloldalt, májunk jobboldalt helyezkedik el. A fordított állapot, a Situs inversus előfordulási valószínűsége mindössze 0,014%. Összenőtt ikreknél a baloldali partner normális, míg a jobboldali belső szerveinek elrendeződése fordított. Már látásunk sem szimmetrikus – általában a jobb szem dominál – nem beszélve kezeinkről. Az emberek többsége jobbkezes, használati tárgyaink, pl. a dugóhúzó a jobbkezeseknek „esik kézre”. Az emberek 15-20%-ának nehézséget okoz a jobb és bal megkülönböztetése, ami nem függ össze a szellemi képességekkel. A „jobb/bal vakság” a híres fizikusnak, Helmholtz-nak is gondot okozott.
A jobb és bal nem új keletű fogalmak. Már a Bibliában is találkozunk vele. Az Úr így szólt Jónás-hoz: „Én pedig ne szánjam Ninivét, a nagy várost, a melyben több van tizenkétszer tízezer embernél, a kik nem tudnak különbséget tenni jobb- és balkezük között, és barom is sok van?!” (Jónás könyve 4.11) A jobb és bal fogalma szerepel a politikában (jobboldal/baloldal) és a nyelvben is. A right szó az angolban a jobb mellett a helyeset is jelenti. Az orosz nyelvben a pravo a jobb mellett jogot jelent; a Pravda újság neve is innen származik. A jobb és balkezesség megmutatkozik a testbeszédünkben is. A jobbkezesek kétharmada úgy kulcsolja össze kezeit, hogy a bal kéz hüvelykujja van fölül. Karjaink összekulcsolásánál hasonló a helyzet. Itt a jobb kéz ujjai látszanak az esetek kétharmadában.
Pasteur érdeklődése a kristályoktól a mikrobiológia felé fordult. Negyed század telt el, amíg a felgyülemlett kémiai tapasztalatokra támaszkodva van’t Hoff (1874, 75; Utrecht) és Le Bel (1874; Párizs) a szerves molekulák optikai forgatóképességét összekapcsolta a molekula kiralitásával. A kiralitás szó Lord Kelvintől (1884) származik (cheir görögül kezet jelent). A királis szerves molekulák legegyszerűbb típusainál a szénatomhoz négy különböző atom vagy csoport kapcsolódik, amelyek egy tetraéder négy csúcsa felé mutatnak. Az ilyen molekuláknak nincs tükörsíkjuk. Van’t Hoff Nobel-díjban részesült, Le Bel-ről elfeledkezett a világ, ez is egy formája az aszimmetriának!
Az optikai aktivitás a II. Világháború után került ismét az érdeklődés középpontjába. A gyógyszeripar felfedezte a szteránvázas vegyületeket. A térszerkezet hatékony vizsgálatára alkalmas röntgenkrisztallográfia vagy NMR módszer még nem létezett, így a polarimetria felé fordult a kutatók érdeklődése. Megjelentek a spektrométerek, amelyek a forgatóképességet a látható és ultraibolya spektrumtartományban folyamatosan regisztrálják, ezt hívjuk optikai rotációs diszperziónak, vagy ORD-nek. Sikerült kifejleszteni egy még hatékonyabb módszert is, a cirkuláris dikroizmus (CD) spektroszkópiát, amely azon alapszik, hogy a tükörképi viszonyban lévő jobb, illetve balkezes királis molekulák az elektromágneses sugárzás jobb és balkezes formáját különböző mértékben nyelik el. A cirkuláris dikroizmus nem más, mint az elnyelés különbsége, a De. A spektroszkópiai módszereket gyűjtőnéven kiroptikának hívjuk, a „kir” a „kezességre”, illetve a kézre utal.
A 40-es években a kémia és biológia frigyéből megszületett a biokémia.
A kutatók elkezdték tanulmányozni a földi élet alapjait jelentő molekulákat,
a fehérjéket. A kiroptika választ adott arra a fontos kérdésre,
hogy a vizsgálni kívánt fehérje a kinyerés – izolálás – során megőrizte-e
természetes (natív) szerkezetét, vagy rendezetlenné vált (denaturálódott).
Akkor még úgy gondolták, hogy egyetlen természetes fehérjeszerkezet létezik:
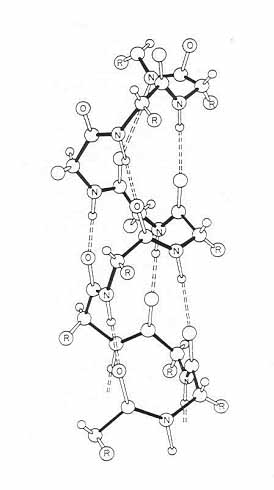
az a-hélix (2. ábra). Később további rendezett
formákat is sikerült azonosítani, ezek a b-szalag
vagy b-redőzött réteg és a kanyarszerkezetek.
A kiroptikai spektroszkópia, elsősorban a cirkuláris dikroizmus nagymértékben
hozzájárult a biokémia fejlődéséhez.
 |
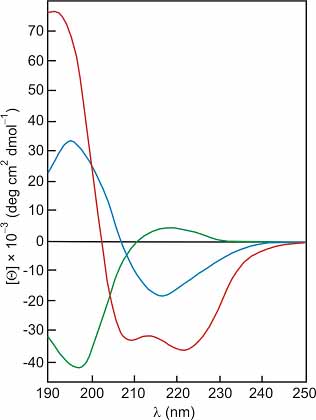 |
2. ábra. Az a-hélix (bal oldalt) és az a-hélix, a b-szalag és a rendezetlen konformáció CD-spektruma (jobb oldalt)
A „hélix” szónál érdemes megállni. A hélix fémcsavarra vagy rugóra hasonlít, külső átmérője nem csökken a haladás irányában. Ez nem érvényes a csigaházra, amely egyetlen ponttá zsugorodik. Néhány „helikális” tárgy: rugók, futónövények, csavart oszlopok, csigalépcsők (ezek viszont nem a csigaházakra emlékeztetnek). A templomokban az oltár két oldalán gyakran állnak csavart oszlopok. A jobboldali a jobbcsavarodású (jobb kezünk begörbített ujjai mutatják a csavarodás irányát, hüvelykujjunk pedig az emelkedés irányát). Az oszlopok elrendezése vallási jelentéssel bír, a jobb a jó fogalmával kapcsolódik össze. Sokáig lehetne sorolni a csavart kiralitású rendszereket és tárgyakat a DNS kettős hélixétől kezdve a kúszónövényeken át egészen a távoli spirálködökig.
Hamarosan fény derült arra is, hogy a biomolekulák – köztük a fehérjék, színhidrátok és nukleinsavak homokirális egységekből épülnek fel. A fehérjéket felépítő aminosavak balkezesek (L-módosulatok), a szénhidrátok és a nukleinsavak cukor-építőkövei pedig jobbkezesek (D-módosulatok). Ez a térszerkezeti homogenitás a földi élet alapja: az életet hordozó magas szervezettségű molekulakomplexek, a sejtek és a szövetek a jobb és balkezes építőkövek keverékéből nem jöhettek volna létre. De a térszerkezeti homogenitás azt is jelenti, hogy az élő szervezetek máshogy reagálnak a környezet jobb és balkezes molekuláira. Ezt hívjuk diasztereomer megkülönböztetésnek (dd).
A diasztereomer megkülönböztetés első bizonyított példája az aszparagin: a nem-természetes (D)-(+)-aszparagin édes ízű, míg a természetes (L)-(-)-aszparagin íztelen. A sztereoizomerek különböző ízhatása meglehetősen általános, de vannak kivételek. Néhány monoszacharid nem-természetes (L) formája is édes, az ellenpélda az édesítőszerként használt aszpartám (aszpartil-fenilalanin-metilészter, Asp-Phe-OMe), a négy sztereoizomer közül csak az egyik (L,L-forma) édes.
Hasonló a helyzet a szagérzet esetében. Az egyik optikailag aktív
karvon módosulat [(S)-(+)-karvon] köményillatú, míg az (R)
mentolillatú. Az (R)-(+)-limonén narancs-, míg az (S)-(-)
módosulat citromillatú. Hűsítő füsthatása a cigarettában csak a természetes
(-)-mentolnak van (1. táblázat).
1. táblázat. Diasztereomer megkülönböztetés: ízek, illatok és biológiai hatásÍzek
(L)-(-)aszparagin íztelen
D-(+)-aszparagin édes(L,L)-aszpartil-fenilalanin-metilészter (aszpartám) édes
(D,D), (L,D), (D,L)-aszpartil-fenilalanin-metilészter nem édesIllatok
(S)-(+)-karvon köményillatú
(R)-(-)-karvon mentolillatú(-)-mentol mentolillatú és „ízű”
(R)-(+)-limonén narancsillatú
(S)-(-)-limonén citromillatúBiológiai hatás
(R)-nikotin (nem természetes) kevésbé toxikus
morfin-enantiomer nem hatásos
barbiturát-enantiomer ellentétes hatású
(S)-a-(2-brómfenoxi)-propionsav növényi növekedési hormon (auxin)
(R)-a-(2-brómfenoxi)-propionsav növekedés-gátló
A biológiai hatásspektrum is igen változatos. A nem-természetes
(R)-nikotin kevésbé toxikus, a morfin tükörképi párja (enantiomerje)
nem hatásos, a barbiturát sztereizomerek ellentétes hatást mutatnak, ugyanúgy
ahogy az a-(2-brómfenoxi)-propionsav, amelynek
(S)-enantiomerje növényi növekedési hormon (auxin), míg az (R)-enantiomer
növekedést gátló hatású. Az is előfordul, hogy a fiziológiai hatáshoz mindkét
enantiomerre szükség van.
Rendkívül érdekes a nem természetes jobbkezes (D)-aminosavak biológiája. A lépfene bacillus (anthrax) tokanyaga a g-poli-D-glutaminsav. A fagociták nem emésztik azokat a baktériumokat, amelyeknek a sejtfala D-aminosavat is tartalmaz. Az anthrax virulenciája és rendkívüli fertőzőképessége a kétszeresen is „szokatlan” szerkezetnek köszönhető. (Gondoljunk csak a 2001 szeptember 11-i terrortámadást követő „borítékolt” fehér, halálos porra!). D-aminosavak előfordulnak antibiotikumokban (pl. a gramicidin S-ben). Kimutattak D-aminosavakat sokéves borokban és előkezelt élelmiszerekben. Fontos megfigyelés volt, hogy a nem-megújuló fehérjéink (ilyen pl. a szemlencse krisztallinja vagy az idegsejtek fehérjéi) egyes aminosavrészei (elsősorban a szerin és aszparaginsav) lassú racemizációt szenvednek. A racemizáció olyan szerkezeti változásokat idézhet elő, amelyek kóros folyamatokhoz és betegségekhez vezethetnek.
A magyar szerves kémikusok is hamar felismerték az optikai aktivitás térkémiai jelentőségét. Bruckner Győző - aki 1951-70 között vezette az ELTE Szerves Kémiai Tanszékét - még Szegeden, a mikrobiológus Ivanovics György professzorral együttműködve izolálta az anthrax polipeptidet és kezdte el szerkezetének tanulmányozását. A térszerkezet kiroptikai (ORD) spektroszkópiai vizsgálata a 60-as években már Kajtár Márton nevéhez fűződik. Ő alapította meg az ELTE, Szerves Kémiai Tanszék Kiroptikai Spektroszkópiai Laboratóriumát (KSL).
Tudományos pályafutásomat az anthrax peptidek kiroptikai spektroszkópiai vizsgálatával kezdtem. Posztdoktorként Th. Wieland Intézetében, Heidelbergben töltöttem egy évet. Wieland professzor az európai peptid- és fehérjekémia egyik megteremtője volt, kutatásainak középpontjában a gyilkos galóca (Amanita phalloides) toxinjainak vizsgálata állt. 1986-ban Bostonban dolgoztam G.D. Fasman mellett a Brandeis Egyetemen. Fasman professzor a fehérjék CD spektroszkópiájának egyik úttörője, a vele közös munka közel tíz évig tartott.
Az elmúlt évtizedekben a figyelem a sztereoizoméria farmakológiai szerepének tisztázása felé fordult. 1961-ben hozták forgalomba Európában a Thalidomide nevű racém gyógyszert, amelyet nyugtatóként és álmatlanság ellen ajánlottak terhes asszonyoknak. Kiderült, hogy a gyógyszer teratogén hatású, tömegesen születtek gyermekek torzult végtagokkal. 1980-ra tisztázták, hogy csak az egyik módosulat [(S)-(-) sztereoizomer] teratogén, a másik ártalmatlan. A tragédia nemzetközi botrányhoz vezetett, de az Egyesült Államok illetékes hivatala, a Food and Drug Administration (FDA) csak 1988-tól követelte meg, hogy a gyógyszergyárak adatokat szolgáltassanak a készítmény enantiomer-összetételéről. Ma már nyilvánvaló, hogy a diasztereomer diszkrimináció döntő fontosságú az orvosi kémiában. A Thalidomide készítményt újabban lepra kezelésére használják. A történet újabb fordulatot vett akkor, amikor kiderült, hogy a molekula fiziológiás körülmények között racemizációt szenved.
A Thalidomide botrány megrendítette a bizalmat a hagyományos, keverék hatóanyagot tartalmazó gyógyszerek iránt. De az optikailag tiszta, jobb vagy balkezes hatóanyagot tartalmazó gyógyszerek kifejlesztése sokkalta drágább mint a keveréket (racemátot) tartalmazóké. A keveréket szét kell választani és megvizsgálni, hogy melyik a hatásos, esetleg nincs-e a másik módosulatnak valamilyen más, gyógyászati szempontból hasznos hatása. A szétválasztás nem könnyű és főleg nem olcsó. Célravezetőbb a jobb, illetve balkezes molekulákat irányított, térkémiai szempontból szelektív módon előállítani. Ez az igény új alapokra helyezte a gyógyszerkutatást és fejlesztést: az „egykezesség” eléréséhez „egykezes” segédanyagok – oldószerek, reagensek, katalizátorok – szükségesek.
Egy statisztika szerint 1993-ban a szintetikus hatóanyagot tartalmazó gyógyszerek száma 1300 körül volt, közülük kb. 500 tartalmazott királis hatóanyag molekulát. De csak 61 hatóanyaga volt „egykezes”. A helyzet azóta sokat javult, de még mindig bőven vannak keverékek gyógyszertári forgalomban. A gyógyszeripart és piacot jelentős mértékben befolyásoló amerikai FDA néhány éve csak enantiomer hatóanyagot tartalmazó készítmények forgalmazását engedélyezi.
Hasonló a helyzet a mezőgazdasági vegyszerek előállítása terén is. Azt hiszem, nem túlzás azt feltételezni, hogy éveken belül uralkodóvá válnak az egykezes kozmetikumok is. Az is várható, hogy az ételízesítők és ízpótlók – ezek már majdnem minden tasakos vagy dobozos, üveges készítményben megtalálhatók – hatóanyagai a jövőben csak az egyik optikai izomert tartalmazhatják. A másik jó esetben hatástalan (ballaszt), de lehet nehezen emészthető, esetleg toxikus is.
Biológiai megkülönböztetés akkor is történik, ha a királis molekulának hírvivő (messenger) szerepe van. Ennek értelmezésére dolgozták ki a hárompontos illeszkedés modelljét. Könnyen belátható, hogy a kedvező kölcsönhatás térbeli követelményeinek csak az egyik enantiomer tud eleget tenni. Biológiai rendszerekben azonban a helyzet meglehetősen bonyolult, hiszen szerepet játszik a kötéserősség és a transzport, továbbá előfordulhat az is, hogy az ellentétes kiralitású módosulat másik receptorhoz kötődik.
Munkáim nagy része az exciton mechanizmuson alapuló cirkuláris dikroizmussal kapcsolatos. Két egymáshoz közeli, nagy átmeneti elektromos momentummal rendelkező független kromofor csoport királis (csavart) térbeli elrendeződése olyan kölcsönhatáshoz (dinamikus csatolás) vezet, amelynek eredményeképpen egy ellentétes előjelű sávpár (exciton couplet) jelenik meg a CD spektrumban. A couplet előjeléből, amely nem más mint a nagyobb hullámhossz értéknél jelentkező sávkomponens előjele, következtetni lehet a kiralitáscentrumok konfigurációjára. Az “exciton” kifejezés Davidov molekuláris exciton elméletével (1962) kapcsolatos, míg a módszer első alkalmazását glikolok abszolut konfigurációjának meghatározására Harada és Nakanishi közölte (1969). Az OH-csoport nem kromofor, (nem nyel el a látható, vagy ahhoz közeli hullámhossztartományban), ezért a CD vizsgálatok előtt a glikolokat dibenzoil-származékká alakították. Az exciton-csatolt cirkuláris dikroizmus (EC-CD) mára az abszolut konfiguráció meghatározásának egyik legmegbízhatóbb, a Bijvoet-féle röntgenkrisztallográfiai eljárással összehasonlítható módszerévé vált.
Az EC-CD spektrumok fő jellegzetessége a felhasadt (nemdegeneratív) sávpár kiugróan nagy intenzitása. A módszer elméleti alapja az, hogy a kromoforok azonos vagy közel azonos gerjesztési energiát igénylő elektronátmeneteit nem lehet egymástól függetlenül kezelni, mert ez megsértené a Heisenberg-féle bizonytalansági elvet. A közös, felhasadt gerjesztett állapotok közötti energiakülönbség a Davidov-felhasadás. A felhasadás következtében a CD spektrumban egy ellentétes előjelű sávpár (couplet) jelenik meg. A couplet előjele nem más mint a nagyobb hullámhosszúságú sáv előjele, vagyis az ábrán jobboldalt egy pozitív couplet látható.
A dibenzoát-észterek esetében az UV spektrumban 230 nm táján megfigyelhető intenzív elnyelés a (p-szubsztituált) benzolgyűrűt és a COOR csoportot magába foglaló töltésátviteli sávnak felel meg. A baloldali abszolút konformációban a couplet negatív előjele megegyezik a torziószög (w) előjelével. Könnyen belátható, hogy a tükörképi elrendeződés (ellentétes konfiguráció) pozitív coupletet és pozitiv torziószöget jelent (3. ábra).
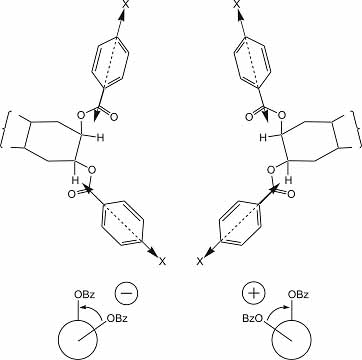
3. ábra A dibenzoát-észterek térszerkezete
Az exciton csatolásnak szigorú térkémiai feltételei vannak. Így pl. az exciton couplet amplitúdója fordítottan arányos a kromoforok közötti távolság négyzetével. Előnyös, ha a kromoforok térben közel vannak egymáshoz, bár nem kell, hogy szomszédos helyzetűek legyenek. Meglepő módon 2,17-dihidroxi-szteroidok benzoátjainál még sikeresen használható a módszer. A couplet amplitúdója a dibenzoát rendszernél akkor a legnagyobb, ha w@70°. Az amplitudó nulla, ha w=0° vagy 180°. Ez a feltétel arra vezethető vissza, hogy a parallel dipóluselrendeződés nem eredményez cirkuláris töltéselmozdulást, azaz a gerjesztés során mágneses momentum nem indukálódik. Nem árt azt sem hangsúlyozni, hogy EC-CD spektrumot nemcsak azonos szimmetriájú elektronátmenetek eredményezhetnek. A lényeges az, hogy a gerjesztési energiák csak kismértékben különbözzenek egymástól. Megfigyelhető intermolekuláris EC-CD spektrum is pl. szupramolekuláris komplexek esetében. Helikális szerkezetű fehérjék CD spektrumában megjelenő negatív pp* sávpár is exciton csatolásra vezethető vissza (2. ábra).
Gráf Lászlóval (ELTE Biokémiai Tanszék) együttműködve dolgoztam az opiát peptidek, a b-endorfin és enkefalinok térszerkezetének feltérképezésében. Az opiát szó arra utal, hogy ezeknek a peptideknek morfinszerű hatása van.
A ciklopeptidek, vagyis a gyűrűs peptidek szerkezetvizsgálata irányította figyelmemet a fehérjék kanyar (turn) szerkezetének vizsgálata felé. A CD spektroszkópia mellett itt már Kálmán Alajossal (MTA KKKI) együttműködve röntgenkrisztallográfiát és elsősorban NMR spektroszkópiát alkalmaztunk. A néhai Radics Lajos (MTA KKKI) volt az, aki révén megismertem az NMR spektroszkópiában rejlő óriási lehetőségeket, gondoljunk csak az orvosi diagnosztikában egyre szélesebb körben alkalmazott MRI módszerre.
A 80-as évektől foglalkozunk immunogén, T és B sejt epitóp
peptidek vizsgálatával. Az első vizsgálatokat Rajnavölgyi Éva (ELTE
Immunológiai Tanszék) kezdeményezte, később a munkába bekapcsolódott az
ELTE Peptidkémiai Kutatócsoport részéről Hudecz Ferenc, Szegedről Penke
Botond és Tóth Gábor (SZTE Orvosvegytani Intézet), valamint Laczkó Ilona
(MTA SZBK, Biofizikai Intézet). A peptidek flexibilis szerkezetű molekulák,
vizsgálatuk nem könnyű. Ezért fejlesztettük ki a CD spektroszkópia mellett
a vibrációs (infravörös) spektroszkópiát is felhasználó CD/FT-IR módszert
(2. táblázat). Az FT-IR a vibrációs spektroszkópia modern változata. A
kutatásokban részt vettek a Kiroptikai Spektroszkópiai Laboratórium (KSL)
munkatársai, Deckerné Majer Zsuzsanna, Vass Elemér és mások is (ELTE Szerves
Kémiai Tanszék).
2. táblázat. Kiroptikai spektroszkópia az ELTE Szerves Kémiai Tanszékén1965 Oligo- és poli-g-glutaminsavak ORD vizsgálata
1967 Ismétlődő szekvenciájú polipeptidek ORD és IR vizsgálata
1970 Ciklo(oligo-g-glutaminsavak) CD spektroszkópiája
1975-85 Opiát peptidek (b-endorfin és fragmensei, enkefalinok) CD spektroszkópiája
1975-85 Antamanid-analóg gyűrűs peptidek CD, FTIR, NMR és röntgenkrisztallográfiai vizsgálata
1985- Fehérjék és peptidek kanyar (turn) szerkezeti típusainak kiroptikai jellemzése
1985- T és B sejt epitóp peptidek CD jellemzése
1985- Fehérjék CD spektrumának felbontása (konvex peremfeltételű analízis)
1990- Glikopeptidek és foszfopeptidek CD vizsgálata
1990- Antigén peptidek (hemagglutinin fragmensek, stb.) CD spektroszkópiája
1990- A CD/FTIR módszer kifejlesztése és alkalmazása
1990- Az Alzheimer-kórral kapcsolatba hozható peptidek CD/FTIR spektroszkópiai jellemzése
1990- Micellák és liposzómák hatása a peptidek térszerkezetére
1995- Peptid-kation kölcsönhatások CD/FTIR vizsgálata
(CD/FTIR vizsgálatok)
1995- A peptidkonformáció ab initio szintű számítása
1996- Szupramolekuláris (koronaéter stb.) komplexek kiroptikai spektroszkópiája
2003- VCD vizsgálatok
2000- Kriokémiai vizsgálatok
A CD/FT-IR módszert sikeresen alkalmaztuk az Alzheimer-kór
szerkezeti biológiájával kapcsolatos kutatásainkban. Az AK lassan népbetegségnek
számít, az egyik legrégebben ismert konformációs betegség. Ezek
lényege az, hogy normális funkciójú és szerkezetű fehérjék különböző okok
miatt szokatlan szerkezetű aggregátumokat, plakkokat vagy fehérjefonadékokat
képeznek, amelyek elpusztítják a sejteket és szöveteket, legyenek azok
neuronok vagy izületi szövetek. A legmegdöbbentőbb példa a prion betegség,
amely a kuru-t és a szivacsos agyvelőgyulladást okozza. Egy teljesen normális
fehérje válik megmagyarázhatatlan módon gyilkossá!
Saját kezdeményezésű és kooperációs munkáinkról a 2. táblázat nyújt tájékoztatást.
Kutatásaink során eljutottunk a bioinorganikus kémia óriási kihívást jelentő területére. A különböző fémionok komplexképző tulajdonságait elég jól ismerjük. Nincs is baj addig, amíg a fémionhoz azonos ligandumok kapcsolódnak: a fémion ligandumtere és a ligandum együttesen meghatározzák a komplex szerkezetét. Más a helyzet két vagy több ligandum esetében, itt már több geometria lehetséges. Még tovább bonyolódik a helyzet, ha a ligandum egy flexibilis oligopeptid, amely az aminosavszekvencia függvényében különböző ligandumok – idesorolva a peptidgerinc amidcsoportjait is – széles választékát nyújtja. Természetesen biológiai közegben mindig jelen van nagyszámú vízmolekula, szervetlen ion, valamint kisméretű szerves molekula is. Mindez a prebiogén és biogén evolúció során nagyfokú specifitással rendelkező fémionkötőhelyek kialakulásához vezetett.
Vizsgálatainkat kiterjesztettük peptidek és fehérjék kation-komplexeire is. Az ösztönzést az adta, hogy egyes feltételezések szerint az aggregátumok – fonadékok vagy plakkok - kialakulásában, vagyis a fehérjék „összegubancolódásában” fémionok is résztvesznek. A gyanú az alumíniumra terelődött. Ez a fémion az ember természetes földi környezetéhez tartozik, de az élő szervezetekbe bejutó Al-ionok mennyisége az utóbbi időben jelentősen megnőtt. Ennek okai között szerepel a savas eső és bizonyos táplálkozási szokások.
Az Al-ionok elsősorban a Ca2+ kötőhelyeire tudják „befészkelni” magukat. A Ca másodlagos hírvivő, ligandumtere flexibilis, a koordinációs szám 6 és 8 között változhat. A CD/FT-IR módszerrel sikerült igazolnunk, hogy nagyobb ionkoncentráció esetén a Ca2+- és fokozott mértékben az Al-ionok elősegítik háromdimenziós b-aggregátumok képződését elsősorban a negatív töltésű Asp és Glu oldalláncok COO--csoportjai közötti taszítás megszüntetése révén.
Mivel foglalkozunk most? Kutatási témáink közé tartozik az úgynevezett szupramolekuláris komplexek kiroptikai tulajdonságainak vizsgálata Huszthy Péterrel és a Műegyetem Szerves Kémia Tanszékével folytatott kollaboráció keretében. Huszthy Péter és munkatársai az elmúlt két évtizedben nagyszámú királis piridino-, fenazino-, akridino- és akridono-18-korona-6 vegyületet állítottak elő enantiomertiszta formában. A mi feladatunk az arilalkilammónium sókkal képezett szupramolekuláris komplexek CD spektropszkópiai vizsgálata volt. A 4. ábrán egy fenazino koronaéter enantiomer a-(1-naftil)-etilammónium perklorát sókkal képezett komplexeinek CD spektruma látható. A heterokirális – (R,R)-korona/(S)-ligandum – komplex spektrumában látható exciton sávok intenzitása jóval nagyobb, mint a komponenseké. Pedig itt nincs kovalens kapcsolat a korona és a ligandum között! A homokirális – (R,R)/(R) – komplex CD spektruma is exciton kölcsönhatásról árulkodik, bár itt a stabilitási vagy térkémiai viszonyok kevésbé kedvezőek.
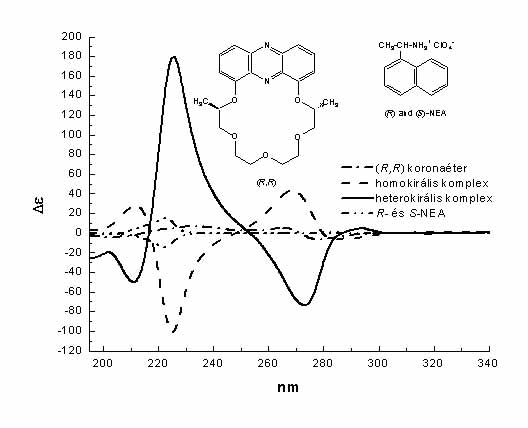
4. ábra. Koronaéter komplexek CD spektruma
Kézenfekvő volt, hogy megvizsgáljuk, milyen koronaéter komplexek képződnek
gömbszimmetrikus töltéssűrűségű „közönséges” kationokkal. Na+,
K+, Mg2+, Ca2+, valamint néhány átmenetifém
kation (Ag+, Zn2+, Ni2+, Cd2+,
Pb2+) hatását vizsgáltuk. A CD spektrumok alapján a kationok
jelentős részénél stabilis komplexek képződésére lehetett következtetni.
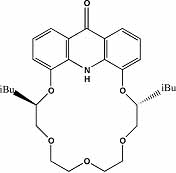
Voltak azonban kivételek is. Az akridono-18-korona-6 vegyület CD spektruma
alig változott a vizsgált kationok szokásos feleslegének jelenlétében,
ami a komplexképzés elmaradására, vagy a komplex kis stabilitására engedett
következtetni. Más volt a helyzet Pb2+ ionok jelenlétében. A
spektrum stabilis komplexképződésre és nagy szelektivitásra utal (5. ábra).
 |
 |
5. ábra Egy akridono-típusú koronaéter fémion-komplexeinek CD spektruma
Megfelelő (pl. allil-típusú) kapcsoló-csoport lehetőséget teremt a koronaéter szilárd hordozóhoz való kötésére és Pb2+-specifikus kromatográfiás állófázis készítésére. A szek-butil-csoportokkal szubsztituált (S,S)-fenazino-18-korona-6 ligandum Na+, K+ és Pb2+ ionokkal 1:1 komplexet képez. Ami meglepő az az, hogy a CD spektrumban exciton felhasadásra utaló sávpár jelenik meg. Ez csak úgy lehetséges, hogy az 1:1 fémionkomplexek szuperkomplexet képeznek. Ebben a makrociklusok illeszkedése vagy parallel vagy pedig antiparallel, de az exciton kölcsönhatás kialakulásához a heteroaromás gyűrűknek közel kell kerülniük egymáshoz. A feltételezett szuperkomplexet még nem sikerült kristályos formában előállítani. Ab initio szintű geometriaoptimalizálással próbálunk a legvalószínűbb illeszkedésre következtetni.
A BMGE Szerves Kémia Tanszékén folyó koronaéter-kutatások egyik nem titkolt célja királis HPLC és egyéb töltetek kifejlesztése. Nemrég egy allilcsoporttal módosított piridino-18-korona-6 étert sikerült szilika-hordozóhoz kapcsolni, majd királis állófázisú HPLC oszlopot készíteni. Az oszlop kiválóan működik, sikerült több racém aralkilammónium-sót és racém aromás aminosavat jó retenciós idő különbséggel szétválasztani. További terveink között fiziológiás aril-aminok elválasztása szerepel.
Szintetikus vegyészként kezdtem pályámat, de eljutottam a biomolekuláris kémiához és biospektroszkópiához. Ez többé-kevésbé szükségszerű volt. Az ELTE spektroszkópiai műhelye sokáig az egyetlen kémia-orientált kiroptikai kutatóhely volt az országban. Ma már közel tíz CD spektrométer működik az országban, ami jól mutatja a módszer növekvő jelentőségét.
A kiroptikai jelenségek nemcsak az elektromágneses sugárzás látható és ultraibolya tartományában tanulmányozhatók. A CD/FT-IR módszer kapcsán már szóba került a vibrációs spektrumtartomány. Ez rendkívül információgazdag területe az elektromágneses spektrumnak és ahogy ma fogalmazunk: a vibrációs spektrumok a legmagasabb, ab initio elméleti kémiai szinten kiszámíthatók.
A vibrációs optikai aktivitás (VOA) a molekulák vibrációs átmeneteinek “balra” cirkulárisan polarizált (bcp) és “jobbra” cirkulárisan polarizált (jcp) elektromágneses sugárzással szembeni különböző viselkedésére vezethető vissza. Két fő méréstechnikai változata van: az infravörös és a Raman. Az IR változat a vibrációs cirkuláris dikroizmus (VCD), a Raman pedig a Raman optikai aktivitás (ROA). A VCD a bcp és jcp IR sugárzás elnyelésének különbsége (De=eb-ej), legegyszerűbb alkalmazása a királis minta optikai tisztaságának meghatározása. A két módszer sikere annak köszönhető, hogy alkalmasak abszolut konfiguráció, vagy biopolimerek esetében az abszolut konformáció (másodlagos szerkezet) meghatározására. A kromofor csoportok nagy száma és változatossága megbízható sztereokémiai vizsgálatokat tesz lehetővé.
2003-ban sikerült beszereznünk egy vibrációs CD spektrométert a szükséges számítógépekkel együtt. A műszer – amely unikális az országban – ma már működik. A következő spektrumot (6. ábra) már a KSL VCD spektrométerével vettük fel. A szerkezet mozgékony, ez tükröződik a nagy zajszintben. De a szubsztituált ciklobutanon ketoncsoportja minden konformer esetén pozitív sávot ad 1775 cm-1 táján. Ez a számítások szerint a propenilcsoportot hordozó kiralitáscentrum (S)-konfigurációját jelenti.
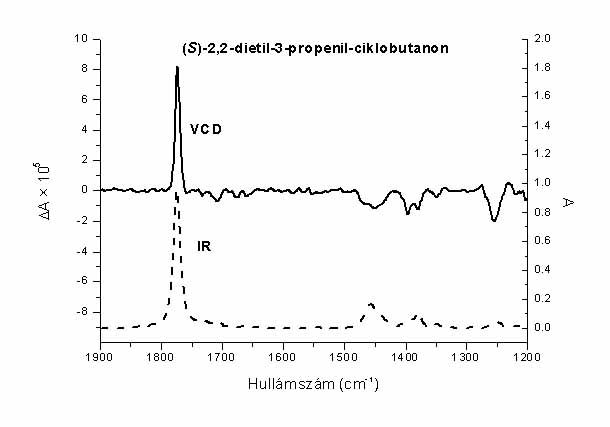
6. ábra Egy ciklobutanon-származék szerkezete és VCD spektruma
Minden remény megvan arra, hogy a VCD spektroszkópia a közeljövőben lehetőséget teremt a rutinszerű abszolút konfiguráció meghatározásra. Nincs szükség egykristályra, vagy hosszadalmas retro-szintézisre. Elég, ha a méréssel párhuzamosan elvégezzük a szükséges kvantumkémiai számításokat. Ha az építőkövek abszolút konfigurációja ismert – ez a helyzet biopolimerek esetében – úgy a VCD spektrumok és a számítások alapján az abszolút konformációra lehet következtetni. A VCD módszer lényege az egyik vagy a másik enantiomer spektrumának ab initio szintű kiszámítása és a számított valamint a mért spektrum összehasonlítása. Mivel a VCD spektrum nagyszámú váltakozó előjelű sávot tartalmaz, az összehasonlítás rendkívül biztonságos. Ha a mért és számított spektrum sávjainak helyzete és előjelmintázata megegyezik, úgy az abszolút konfiguráció megegyezik a választott enantiomer konfigurációjával, ha tükörképi, úgy a konfiguráció ellentétes. A 90-es években a sűrűség-függvény elmélet (density functional theory, DFT) olyan sokat fejlődött, hogy drámai mértékben megnőtt az alap elektronállapottal kapcsolatos tulajdonságok (ideértve az egyensúlyi geometriát, a molekuláris erőtereket és az IR és VCD spektrális intenzitásokat is) kiszámításának pontossága.
A biopolimerek VCD spektroszkópiája az a-helikális homopolipeptidek vizsgálatával kezdődött. Ahogy az IR spektrumban, a VCD spektrumban is az amid I tartomány vizsgálata szolgáltatja a legtöbb adatot. A VCD spektroszkópiai sávgazdagsága, változatos előjel és intenzitás mintázata következtében alkalmas egyes konformációs altípusok megkülönböztetésére. Talán a legfontosabb alkalmazási terület a különböző hélixek megkülönböztetése.
Ezzel eljutottam előadásom végéhez. Mi a földi egykezesség, vagyis
a homokiralitás oka? És miért balkezesek az aminosavak és jobbkezesek a
cukrok? Ezek a kérdések az optikai aktivitás előtérbe kerülésével egyre
többet foglalkoztatják a kutatókat. Valósággal sokkolta a szakmai közvéleményt
az, hogy az ausztráliai Murchison meteoritban olyan egyszerű szerves molekulákat
is találtak, amelyek megtalálhatók a biomolekulák építőkövei között. És
ezek a molekulák az egyik optikailag aktív formából egy kis felesleget
tartalmaznak a vizsgálatok szerint.
Vajda Tamás (ELTE Szerves Kémiai Tanszék) kriokémiai módszerekkel
vizsgálja azt a kérdést, hogy racém aminosavak N-karboxianhidridjeinek
polimerizációja a jégkristály üregeiben eredményezhet-e enantiomerfelesleget
mutató polipeptideket. Úgy tűnik, hogy igen: ez lokális enantiomerfelesleget
előidézhető fluktuációkra vezethető vissza a jégkristályok üregeinek felületén.
Az USA és Európa is a jelenség világűrben történő vizsgálatát tervezi.
A rendkívül érzékeny műszerekkel felszerelt űrszondákkal az optikai aktivitás
eredetének in situ vizsgálatát is tervezik. A Rosetta egy üstökös magjának
felületét fogja analizálni. Az amerikaiak a Szaturnusz holdját, a Titánt
vették célba, a Cassini űrhajó is többek között egykezes királis szerves
molekulák után kutat. A Rosetta ez év márciusában startolt.
Az emberiség egyre lázasabban keresi az élet keletkezésének titkait.
És az egyik legősibb gyökér vitathatatlanul az optikai aktivitás megjelenése
a Földön.
IRODALOM
PERCZEL, A., HOLLÓSI, M. Turns. in: Circular Dichroism and the Conformational Analysis of Biomolecules. Ch. 9. Ed. Fasman, G.D. Plenum Publ. Co, New York (1996) 285-380 pp.
MAJER,ZS., LÁNG,E., VASS,E., SZABÓ,S., HALLGAS,B., AND HOLLÓSI,M., Racemization-induced Defolding and Aggregation of Segments of b-Amyloid Protein: An Early Step in the Formation of Amyloid Plaques, Advances in BioChirality, G. Pályi, C. Zucchi and L. Caglioti (Editors), Elsevier, pp. 185-196 (1999)
VASS, E., HOLLÓSI, M., BESSON, F., BUCHET, R. Vibrational Spectroscopic Detection of Beta and Gamma Turns in Synthetic and Natural Peptides and Proteins, Chem. Rev. 103, (2003) 1917-1954
HOLLÓSI, M., LACZKÓ, I., MAJER, ZS. A sztereokémia és kiroptikai
spektroszkópia alapjai, Nemzeti Tankönyvkiadó Rt., Budapest (2004)
Vissza a tartalomjegyzékhez