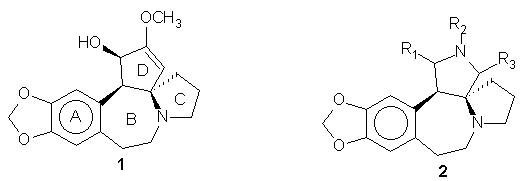
Nyerges Miklós
Cikloaddiciós reakciók felhasználása rákellenes hatású alkaloid-analogonok és flavonoidok elõállításában
Budapesti Mûszaki Egyetem
1996
Eredmények összefoglalása
1.rész. Cephalotaxin alkaloid-analógonok szintézise 1,3-dipoláris cikloaddicióval
A Kelet-Ázsiában õshonos Cephalotaxus fajokban számos rákellenes hatású alkaloidot találtak. Közülük a cephalotaxin (1) érdekes gyûrûrendszere, észterszármazékainak biológiai aktivitása és nehéz hozzáférhetõsége sok kutató érdeklõdését keltette fel.
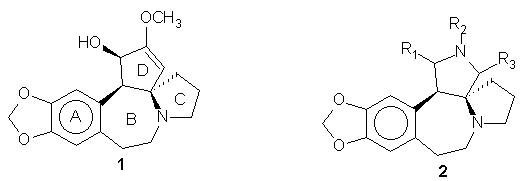
A 2 aza-analogon elõállításának érdekében a nem-stabilizált azometin-ilidek és b -nitro-sztirolok közötti 1,3-dipoláris cikloaddiciót részletesebben is tanulmányoztam. A szarkozin és paraformaldehid dekarboxilatív kondenzációja során keletkezõ dipól kilenc féle b -nitro-sztirol típusú vegyülettel a várt reaktivitással és az AM1 számításokkal jól korrelálva, általában jó termeléssel adta a transz-3-aril-4-nitro-pirrolidineket. A cikloadduktokat a célul kitûzött analogonok C-gyûrûjének felépítése céljából Triton B bázis jelenlétében metil-akriláttal reagáltattam, majd reduktív spirociklizációval alakítottam ki a spiro-anellált laktám gyûrût. A sztereospecifikus Michael-addiciót követõ lépés azonban érdekes módon cisz és transz-laktámok elegyét adta. Hasonló problémával más cikloadduktok átalakítása során is találkoztam.
Glicin-etilészterbõl és benzaldehidbõl elõállítható észter-stabilizált azometin-ilidek b -nitro-sztirolokra való 1,3-dipoláris cikloaddiciójának sztereoszelektivitását külön is megvizsgáltam: a cikloaddició exo-endo szelektivitása a katalizátor (AgOAc, LiBr) cseréjével megfordítható volt.
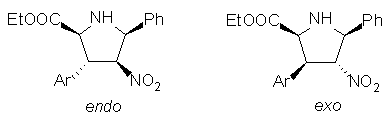
Az endo-cikloadduktok továbbalakítása a kulcsintermedier spiropirrolidin származékká (3) sztereoszelektív volt, de belõle a kívánt cephalotaxin-geometriától eltérõ vázú nor-analogont lehetett felépíteni.
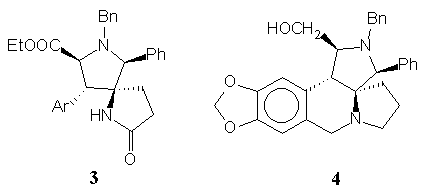
Az exo-cikloadduktból kiindulva 5 lépésben sikerült megvalósítani egy nor-azacephalotaxin analogon (6) szintézisét.
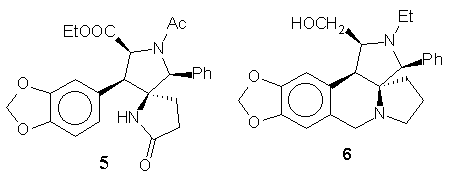
Hasonló lépések sorozatával terveztem felépíteni egy másik exo-cikloadduktból (Ar = N-metil-indol-3-il) a 8 indolo-analogont. A megfelelõ spiro-amin Pictet-Spengler reakciója azonban nem a várt eredményt adta: a formaldehid a szekunder nitrogénen támadva hidroximetil-csoportot vitt be, melybõl az indol-gyûrû b -poziciójának elektrofil támadása révén létrejön az áthidalás és egy újabb spiro-anellált gyûrû. Az a -helyzetû elektrofil szénnel a molekulában kedvezõ helyzetben lévõ hidroximetil alkot gyûrûs étert megakadályozva a b -karbolinná való átrendezõdést.
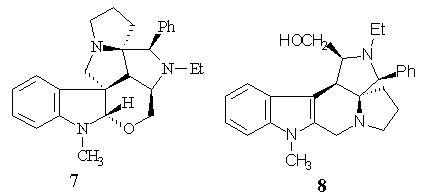
A kívánt indolo-cephalotaxin analogon (8) is felépíthetõ volt a reaktív hidroximetil csoport terc-butil-dimetil-szilil csoporttal való blokkolását követõen. A Pictet-Spengler reakciót Eschenmoser-sóval hajtottam végre.
2. rész. Protein tirozin kináz inhibitor hatású piranoakridonvázas vegyületek szintézise Diels-Alder reakcióval
A PTK-ok jelentõségének felismerése a sejtnövekedés befolyásolásában speciális inhibitorok kifejlesztését hozta magával, amelyek mint potenciális rákellenes szerek és a PTK-ok molekuláris mûködését felderíteni segítõ eszközök lesznek használhatók. A specifikus jelátviteli folyamat inhibeálásával akár a sejtelváltozás is megfordítható lehet a sejt elpusztítása nélkül. A jelenlegi kemoterápiás kezelések mellékhatásainak ismeretében egy olyan gyógyszer felfedezése, amely megõrzi a sejt mûködõképességét rendkívül kívánatos és az antiproliferativ terápia jövõjét is megalapozhatja.
A 4H-pirán-4-onok aktivált butadiénekkel való Diels-Alder cikloaddicióját vizsgálva érdekes megfigyelést tettem: csak a 3-s pozicióban elektronszívó csoporttal szubsztituált heterociklusok reagáltak, a szubsztuálatlan és a 2-s pozícióban észter funkciót tartalmazó származékok nem. A reakció sztereoszelektív volt, a keletkezett cikloaddukt szerkezetét röntgendiffrakciós vizsgálatokkal sikerült egyértelmûen igazolni.
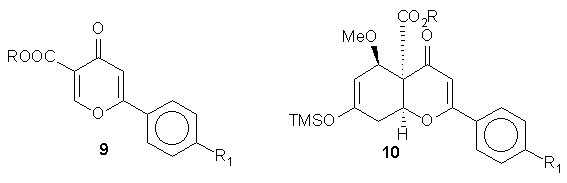
A Diels-Alder adduktok 0.01 M HCl-al szobahõmérsékleten deszililezhetõek voltak, míg TFAA alkalmazása a metoxi-csoport eliminációját is kiváltható volt.
A cikloadduktokat antranilsavszármazékokkal reagáltatva a piranoakridon vázat nem sikerült kialakítani, helyette a telített flavon gyûrûrendszer érdekes degradációja volt megfigyelhetõ.
Application of cycloaddition reactions in the synthesis of antitumor alkaloid analogues and flavonoids
PhD Thesis, Technical University of Budapest,
1996
Part one. Synthesis of Cephalotaxus alkaloid analogues via 1,3-dipolar cycloadditions
Conifers of the genus Cephalotaxine (Cephalotaxaceae) which are indigenous to south east Asia contain a group of alkaloids. These compounds have been the target of much synthetic interest not only due to their potential anticancer chemotherapeutic properties but also because of their unique structure. The aza-, B-nor-aza-, and indolic aza-analogue of cephalotaxine has been prepared stereoselectively using 1,3-dipolar cycloaddition of azomethine ylide as a key step. During this work the 1,3-dipolar cycloadditions of ester stabilised azomethin ylides to aryl-nitro olefines has been investigated in detail. In the reactions catalysed by Li(I) gave products of different stereoselectivity than those arising from processes catalysed by Ag (I). The cycloadditions involve the stereospecific generation of dipoles. The formation of products with reverse stereochemistry when using different metal salt catalysts is caused by the differences in endo and exo approaches of nitro-ethylene compounds. The structure and stereochemistry of the obtained compounds were studied in detail by n.m.r. spectroscopic methods.
Part two. Synthesis of protein tyrosine kinase inhibitor piranoakridones via Diels-Alder reaction
Groundwater and his co-workers have recently described the synthesis of a series of pyranoacridinones which are potent inhibitors of the spontaneous proliferation of a human-derived gastric carcinoma cell line, MKN 45 - but are non-cytotoxic. A key intermediate in the synthesis of these pyranoacridinones is 7-oxo-5,6,7,8-tetrahydroflavone and, as part of this ongoing investigation into the biological potential of these pyranoacridinones, we have become interested in an alternative, more efficient, synthesis of reduced flavones. We have developed a novel method for the synthesis of reduced flavones based on the Diels-Alder reactions. The 4H-pyran-4-ones undergoes Diels-Alder cycloaddition with electron-rich dienes to give the reduced flavones. The 3D structure of one the adduct was confirmed by X-ray crystallography. The reactions of cycloadducts with anthranilonitrile, ethyl anthranilate, HCl and TFAA is described.
Publications
1. Nyerges, M.; Bitter, I.; Kádas, I.; Tóth, G.; Tõke, L. 1,3-Dipolar Cycloaddition Approach towards the Stereo-selective Preparation of Aza-Cephalotaxine Skeleton. Tetrahedron Lett. 1994. 34, 4413.
2. Nyerges, M.; Balázs, L.; Bitter, I.; Kádas, I.; Kövesdi, I.; Tõke, L. trans-3-Aryl-4-Nitro-Pyrrolidines via 1,3-Dipolar Cycloaddition of Nonstabilized Azomethine Ylide to b -Nitro-Styrenes. Tetrahedron 1995, 51, 6783.
3. Nyerges, M.; Bitter, I.; Kádas, I.; Tóth, G.; Tõke, L. 1,3-Dipolar Cycloaddition Approach towards the Stereo-selective Preparation of Aza-Cephalotaxine Skeleton. Tetrahedron 1995, 51, 11489.
4. Nyerges, M.; Rudas, M.; Tóth, G.; Herényi, B. Kádas, I.; Bitter, I.; Tõke, L. Influence of Ag(I) and Li(I) Catalysts for 1,3-Dipolar Cycloaddition Reactions of Azomethine Ylides. Reversal of the Stereochemistry. Tetrahedron 1995, 51, 13321.
5. Groundwater, P.W.; Hibbs, D.E.; Hursthouse, M.B.; Nyerges, M.; An Efficient Synthesis of Reduced Flavones via Diels-Alder Addition to 4H-Pyran-4-ones. Heterocycles 1996, 43, 745.
6. Nyerges, M.; Rudas, M.;Szántay, Cs., Jr.; Bitter, I.; Tõke, L. 1,3-Dipolar Cycloaddition Approach to Indolic Aza-analogues of Cephalotaxine. Tetrahedron 1997, in the press.
7. Groundwater, P.W.; Hibbs, D.E.; Hursthouse, M.B.; Nyerges, M.; Synthesis and reactions of reduced flavones. J.Chem.Soc. Perkin Trans.1 1997, in the press
8. Nyerges M., Tõke L.; Generation of azomethine ylides by condensation of aldehydes with N-substituted a -amino esters. - Nitrogen, Oxygen and Sulfur Ylides in Synthesis: A Practical Approach. Ed. by: Clark J.S.; Oxford University Press 1997 - in the press
| Vissza a tartalomjegyzékhez Back to Contents |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |