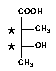
1. ábra
Szabovik Gabriella Ildikó
Szénhidrát szintonok:
Szelektív oxidációk, redukciók, szén-szén kötések kialakítása
doktori (PhD) értekezés összefoglalása
Debreceni Egyetem Természettudományi Kar,
DE-MTA Szénhidrátkémiai Kutatócsoport
Debrecen
2000
Az értekezés elõzményei és célkitûzései
Századunk második felében valamennyi tudományterületen robbanásszerû fejlõdés következett be. Igaz ez a kémiára és ezen belül a szerves kémiára is. A szerves kémián belül a legdinamikusabb fejlõdés a szénhidrátkémián belül tapasztalható. Ennek magyarázata mindenekelõtt az, hogy a szénhidrátszármazékok biológiai szerepeinek ismertté válása (pl. szénhidráttartalmú antioxidánsok, rákellenes szerek, antibiotikumok) és fõleg a glikolipidek, glikoproteinek esetében feltételezett és a bizonyítás folyamatában levõ hatások (megtermékenyítés, sejtosztódás, sejtdifferen–ciálódás, sejt-sejt kölcsönhatások, sejt-baktérium, sejt-vírus, sejt-toxin, sejt-hormon, stb.) tényére vezethetõ vissza. Ha az utolsó negyedszázad trendjeit figyeljük a szénhidrátkémián belül három különösen kiemelkedõ gyorsasággal fejlõdõ területet nevezhetünk meg:
– szénhidrát-szénhidrát transzformáció (nukleofil szubsztitúció, oxido-redukciós folyamatok, védõcsoport stratégia),
– az anomer centrumon végbemenõ reakciók (glikozilezési reakciók sztereokémiája, anomer effektusok, szomszédcsoportok hatásának vizsgálata, új glikozil donorok kifejlesztése),
– szénhidrátok alkalmazása királis szintonokként (királis természetes vegyületek szintézise).
A harmadik terület megjelenése és mind divatosabbá váló alkalmazása jelentette és eredményezte a szénhidrátkémia “nagykorúvá” válását, a szénhidrátkémia bevonulását a modern szintetikus kémia, a természetes anyagok kémiája területére.
A DE-Biokémiai Tanszék és a DE-MTA Szénhidrátkémiai Kutatócsoport fõleg az elõzõ két terület mûvelésével foglalkozik és ért el nemzetközileg is számontartott eredményeket. Disszertációm témája az elsõ lépések megtételét jelentik a harmadik területen és ugyancsak három részre tagolódik az alábbiak szerint:
szénhidrátok alkalmazása királis szintonokként,A három területet egyrészt a biológiai motiváció, másrészt a karbanionok alkalmazása és különbözõ oxidációs állapotú szénhidrátszármazékok egymásba történõ átalakítása kapcsolja össze.aldóz-2-uloszonsavak szulfonometil analógjainak elõállítása,
egy új MgH2-alapú fémhidrid bevezetése a szénhidrátkémiába.
Az alkalmazott vizsgálati módszerek
Szintetikus munkám során a modern preparatív szerves kémia makro-, félmikro- és mikromódszereit alkalmaztam.
A reakciók követésére, az anyagok tisztaságának ellenõrzésére, a termékarányok meghatározására vékonyréteg-, nagynyomású folyadék- és gázkromatográfiát használtam. A nyerstermékek tisztítását, az izomerek elválasztását a klasszikus kristályosításon kívül oszlopkromatográfia segítségével oldottam meg.
Az elõállított vegyületek szerkezetének
igazolására a klasszikus eljárások (elemanalízis,
olvadáspont és fajlagos forgatóképesség
meghatározása) mellett a modern NMR spektroszkópiát
alkalmaztam.
Az értekezés új tudományos eredményei
III.1. 2,4-Didezoxi-2-C-metil-tetrózok szintézise
Számos természetes vegyület szintézise valósítható meg királis templátokból a kiralitáscentrumok minimális módosításával. Figyelmem egy olyan kis molekulára összpontosult, amely több természetes vegyület szénhidrát részének észteresítõ komponense. Ez a vegyület nevezetesen a nilin savként ismert 3-hidroxi-2-metil butánsav (1. ábra), mely megtalálható a Convolvulaceae család egyes tagjaiban, valamint a Mycobacterium avium 17-es szerovariáns sejtfelszín glikoproteinjének immundetermináns pentaszacharidjának terminális aminocukra is ezzel a származékkal acilezett.
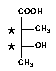
1. ábra
A két királis centrumot hordozó sav négy izomer formában létezhet. A fent említett természetes anyagok szerkezetfelderítései során a savak abszolút konfigurációját a legtöbb esetben nem határozták meg.
Célkitûzésem volt a közvetlen prekurzorként alkalmazható négy tetróz izomer elõállítása, ennek során a vajsav izomerek szerkezetét szénhidrátokra vezettem vissza (2. ábra).
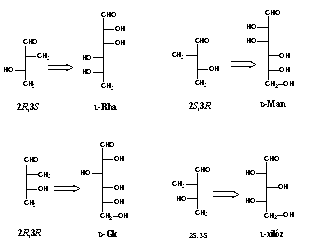
2. ábra
A 2R,3S-izomert L-ramnózból, a 2S,3R-izomert D-mannózból, a 2R,3R-izomert L-xilózból, a 2S,3S-izomert pedig D-glükózból vezettem le.
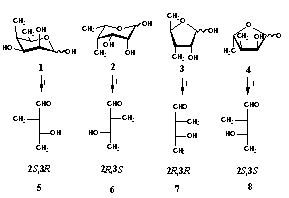
i. NaIO4, EtOH: H2O
3. ábra
A szintézisek során új vegyületként nyertem a 4,6-didezoxi-4-C-metil-D-talózt (1), a 4,6-didezoxi-4-C-metil-L-talózt (2), ezek a -metil glikozidjait, a 3,5-didezoxi-3-C-metil-D-ribózt (3), a 3,5-didezoxi-3-C-metil-L-ribózt (4), továbbá négy tetrózt a 2,4-didezoxi-2-C-metil-D-treózt (5), az -L-treózt (6), a –D-eritrózt (7) és az -L-eritrózt (8). Mind a négy izomer 2-C-metil szubsztituenseit a megfelelõ ulozid származékokból, Wittig reakcióval C-metilén származékokon keresztül sztereoszelektív redukcióval vezettem be a gyûrûs szerkezetû szénhidrát szintonokba (3. ábra).
Ugyancsak új eredmény a modell vegyületként alkalmazott 2,4-di-O-metil-D-eritróz (9), valamint az utóbbiból levezethetõ, teljesen védett aldonsav származék (10) is (4. ábra).
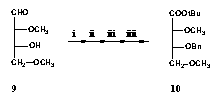
i. (CH3O)3CH, CH2Cl2, H+; ii. BnBr, NaH, DMF; iii. TFA, CH2Cl2, kat. H2O; iiii. tBuOH, PDC, CH2Cl2.
4. ábra
III.2. Aldóz-2-uloszonsavak szulfonometil analógok tioglikozidjainak elõállítása
Biológiailag aktív szialil Lewis X mimetikumok elõállításához eddig ismeretlen szerkezetû szulfo-uloszonsav származékok elõállítására alkalmas eljárást dolgoztam ki a különbözõ szubsztituált aldonsav-laktonok és metánszulfonsav-etilészterbõl generált karbanionok nukleofil addíciós reakciójával.
A védett D- és L-aldonsav-laktonokat Dess-Martin-perjodinános módszerrel szintetizáltam, mely magasabb kitermelést eredményezett a megszokott PCC-os módszernél. Megállapítottam, hogy valamennyi vizsgált esetben kizárólagosan a -anomer szulfo-uloszonsav-származékok keletkeztek, amelyekbõl retencióval tioetil-glikozid-származékok preparálására nyílt lehetõség (5. ábra).
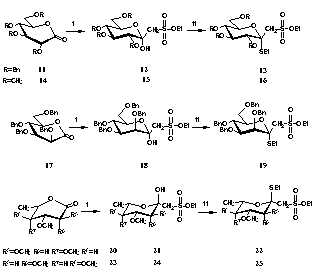
i. CH3SO3Et, n-BuLi, THF; ii. EtSH, Et2O·BF3, CH2Cl2.
5. ábra
Valamennyi általam szintetizált szulfo-uloszonsavak etil-tioglikozidjaival számos szialil Lewis X mimetikum preparálása történt meg. Amennyiben biológiailag aktívnak bizonyulnak, gyógyszer és/vagy diagnosztikai felhasználásuk is lehetséges.
A szulfonsavak újonnan kialakuló anomer centrumán
a konfiguráció hozzárendelését részben
3JC,H csatolási állandók meghatározásával,
részben hetero-NOE mérések segítségével
állapítottuk meg, és kiderült, hogy az anomer
effektus révén az újonnan kialakuló anomer
centrumon az OH-2 mindig axiális térállású,
azaz a vegyületek a -anomerek.
III.3. MgH2-alapú fémhidridek szénhidrátok területére történõ bevezetése
Vizsgálataim során rendszeresen változtatni kellett
a különbözõ szénhidrátmolekulákban
az egyes C-atomok oxidációs állapotát. Ennek
során egy új magnézium-hidrid (MgH2) alapú,
komplex hidrid reagenst:
elsõként vezettünk be a szénhidrátok területére. Részletesen vizsgáltam a C=C-kötés, aldehidek, ketonok redukálhatóságát és a reakciók sztereokémiai lefutását, néhány epoxid felnyílását, a legkülönbözõbb védõcsoportok kompatibilitását az alkalmazott reakciófeltételek között.6 MgH2 + (3+n)AlCl3 + yTHF ®
3[Mg2Cl3(THF)y]+ [AlH4-nCln]- + nAl + n/2H2
Megállapítottam, hogy a reagens a C=C-kötést nem támadja, az oxofunkciókat hidroxi-származékokká redukálja, s a reakció sztereoszelektivitását a C=O kötés polarizációja révén kialakuló karbónium kation sztérikus megközelíthetõsége határozza meg, így a reakció lefutása az oxo-szubsztrát szerkezetének ismeretében megjósolható. Hasonló törvényszerûséget tapasztaltam az általam vizsgált epoxidok esetében is. A reagens csak az oxirán típusú vegyületeket redukálja, oxetán, tetrahidrofurán vázak, továbbá a glikozidok is- a gyûrûtagszámtól függetlenül- stabilak az alkalmazott körülmények között.
A reagens, az alkalmazott reakciókörülmények között, a különbözõ védõcsoportok (pl. éterek: metil, allil, benzil; acetálok: izopropilidén, benzilidén, fluorenilidén) jelenlétében is eredményesen alkalmazható.
Az alkalmazott új hidrid reagenssel végzett reakciók mind a hozamok, mind a sztereoszelektivitás vonatkozásában alkalmasnak bizonyultak a szénhidrátkémiai alkalmazásra. A reagenssel a reakció kivitelezése és a reakcióelegy feldolgozása kényelmesen és biztonsággal elvégezhetõ. Adott esetekben LiAlH4, NaBH4 esetleg NaCNBH3 helyett alkalmazható.
Hálával tartozom Dr. Lipták András akadémikus professzor úrnak, aki munkámat kutatócsoportjában lehetõvé tette, mindvégig figyelemmel kísérte és hasznos tanácsaival segítette.
Carbohydrate synthons:
Selective oxidations, reductions, carbon-carbon bonds formations
PhD Thesis
Debrecen University Faculty of Science,
Research Group for Carbohydrates of the Hungarian Academy of Sciences
Debrecen
2000
Carbohydrates as chiral precursors of the synthesis of natural products
Over the years, carbohydrates have been recognized as naturally occurring
organic compounds endowed with a wealth of stereochemical attributions.
The thrust of research in this area has been inspired by biochemical events
and has fostered an accelerated effort in the synthesis and chemical modification
of component sugar units. Carbohydrates are a relatively cheap and replenishable
source of chiral carbon compounds, available in a variety of cyclic and
acyclic forms, chain lengths, and oxidation or reduction states. They ensure
a measure of regio- and stereocontrol in bond-forming reactions that are
not easily matched by other classes of organic compounds. With carbohydrates
as starting materials, one has the option of creating or destroying asymmetric
centres through chemical manipulation of existing functionality by chain-extension,
chain-branching or cleavage.
Synthesis of 2,4-dideoxy-2-C-methyl tetroses
My research interest has been focused on 3-hydroxy-2-methyl butyric acid (nilic acid) which is the acyl component of different natural compounds isolated from plants (Convolvulaceae) or bacteria (Mycobacterium avium serovar 17).
1. scheme
Structural studies have shown that resin glycosides, which are one of the most common constituents of the Convolvulaceae family are quite commonly acylated by some organic acids (acetic, propionic, 2-methylbutyric, tiglic, nilic, n-valeric, etc.) at the sugar moiety.
Mycobacteria (members of the Mycobacterium genus) remain a serious problem in the diseases caused by them. Recently growing interest has been focused on the Mycobacterium avium- M. intracellulare- M. scrofulaceum (MAIS)serocomplex, because being opportunistic pathogens several serovariants, cause infections among patients with acquired immunodeficiency syndrome (AIDS). Member serovariants of the M. avium complex are distinguished by a set of highly characteristic tetrapeptide containing surface glycolipids (GLPs). The antigenic specificity is due to the structural variability at the nonreducing terminus of the haptenic oligosaccharide.
The terminal amino sugar unit of the immundeterminant pentasaccharide of the cell surface glycoprotein of the Mycobacterium avium serovar 17 also acylated with 3-hydroxy-2-methyl butyric acid.
This 3-hydroxy-2-methyl butyric acid has two chiral centres, consequently it exist in four isomeric forms. In the majority of cases, the configuration of nilic acid has not been assigned in the natural compound. I tried to synthesize all the four isomeric branched chain tetroses which could be regarded as the penultimate precursors of the nilic acid isomers. As I wanted to get the 2R,3S-isomer from L-rhamnose, the 2S,3R-isomer from D-mannose, the 2R,3R-isomer from L-xylose, and the 2S,3S-isomer from D-glucose.

2. scheme
During the synthesis I gained lots of new compounds such as the 4,6-dideoxy-4-C-methyl-D-talose (1), the 4,6-dideoxy-4-C-methyl-L-talose (2), and their a -methyl glycosides, the 3,5-dideoxy-3-C-methyl-D-ribose (3), the 3,5-dideoxy-3-C-methyl-L-ribose (4), and the four tetroses, namely the 2,4-dideoxy-2-C-methyl-D-threose (5), the -L-threose (6), the –D-erythrose (7) and the -L-erythrose (8).

i. NaIO4, EtOH: H2O
3. scheme
The 2-C-methyl substituent was introduced into all the four isomers from the uloside derivatives of the carbohydrates synthons using the Wittig reaction, through C-methylene derivatives and applying stereoselective reduction.
Also a new result the formation of my model compound 2,4-di-O-methyl-D-erythrose
(9), and the fully protected aldonic acid (10) which was
formed from it (4. scheme).
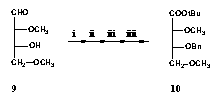
i. (CH3O)3CH, CH2Cl2, H+; ii. BnBr, NaH, DMF; iii. TFA, CH2Cl2, kat. H2O; iiii. tBuOH, PDC, CH2Cl2.
4. scheme
Synthesis of sulfonomethyl analogues of aldose-2-ulosonic acids and their thio-glycosides
Selectins are carbohydrate-binding transmembrane glycoproteins expressed on platelets (P-selectins), leukocytes (L-selectins) and endothelial cells (E- and P-selectins), mediating the first steps of the recruitment of leukocytes from the blood stream to sites of inflammation in a series of normal and pathologic conditions. The carbohydrate ligands recognised by these selectins have recently been identified: E-selectin recognises the sialyl Lewis X (sLe X, or sLex) tetrasaccharide on the surface of leukocytes, P-selectin also binds sLe X on leukocytes, and L-selectin weakly recognizes sLex on endothelial cells.
The selectin-carbohydrate interaction appears at an early stage of the inflammatory reactions or metastasis. When tissue injury occurs, cytokines are released to signal endothelial cells to synthesize E-selectins, which recruit leukocytes to the site of injury. The selectins slow down the movement of leukocytes in the blood vessels, which then roll along the endothelium by binding to glycoproteins bearing sialyl Lewis X ligands. A subsequent close interaction between integrins and leukocytes and the intercellular adhesion molecule (ICAM-1) with the endothelial cells allows the extravasation of neutrophils to the site of injury. When too many leukocytes are recruited, however, normal cells will also be damaged, causing inflammation. The control of this process by inhibiting the adhesion step has been considered as a new anti-inflammatory strategy. (Many acute inflammatory symptoms such as asthma, lung injury, myocardial infarction and arthritis may be treated using this approach.) New antitumor agents could also be developed on the basis of the inhibition of this adhesion process.
Since one of the major natural ligands of the selectins is the sialyl Lewis X tetrasaccharide containing glycopeptide, this tetrasaccharide is taken as the natural lead structure for the development of glycomimetics which structurally resemble and functionally mimic the natural oligosaccharide. These compounds, designed as selectin receptor antagonists, are currently being evaluated as potential anti-adhesive, anti-inflammatory and anti-metastatic drugs.
The structure-activity relationship of the functional groups of sLex is involved in binding to selectins by systematic replacement of the functional groups with hydrogen. It is known that fucose, and some of the galactose hydroxyl groups are essential in binding, furthermore, the acid function in the sialic acid moiety is crucial. The charge of the carboxylic group is presumably essential for binding to biomolecules therefore the substitution of carboxyls by another charged moieties should produce bioactive surrogates. While the phosphonic acid analogues of N-acetylneuraminic acid have been known for a long time, sulfonic acid variants have not been synthesized to date, although several sulfo sugars, having mainly a 6-sulfonic acid moiety, are known.
Indeed, sulfated Lewis X trisaccharide exists, as a natural analogue of sLex and shows superior binding to selectins. By these facts our goal was to synthesize a sulfonic acid type analogue of the sLex tetrasaccharide in which sialic acid is replaced by an anomeric sulfonomethyl-type sugar moiety. The sulfonic acid analogue, being a stronger acid than its carboxylic counterpart, can be assumed to bind effectively to the bioreceptors. Moreover, it may be resistant to esterases, in contrast with the sulfate ester.
The synthesis of the sulfonic acid type analogues of the sLex tetrasaccharide was planned by the introduction of an anomeric sulfonic acid type sugar moiety into a sLex mimic via glycosylation reaction.
Direct substitution of the carboxyl group in N-acetylneuraminic acid, or aldose-2-ulosonic acid in general, by a SO3H group would result in an unstable O,S-acetal, therefore the introduction of the sulfonomethyl moiety appears to be a more promising approach. In this thesis, I wish to present preliminary results on the preparation of sulfonomethyl analogues of aldose-2-ulosonic acids. I synthesized brand new sulfonomethyl analogues of aldose-2-ulosonic acids by the addition of the ethyl methanesulfonate carbanion to aldonolactones.
First I prepared the protected D-aldonolactones and the L-aldonolactone according to the Dess-Martin periodinane method which permitted higher yields than the PCC procedures.

i. CH3SO3Et, n-BuLi, THF; ii. EtSH, Et2O·BF3, CH2Cl2.
5. scheme
Then the lactones were reacted with the ethyl methanesulfonate anion generated with n-butyllithium. Upon nucleophilic addition of the sulfonate ester carbanion to the lactone carbonyl, I obtained each 2-ulosonic acid derivatives in a-anomeric form. The reaction of 12, 15, 18, 21 or 24 with ethanethiol in the presence of Lewis acid resulted in the a-thioglycosides. In the lack of the anomeric proton, the anomeric configuration was determined on the basis of the NMR C1-H3 three-bond coupling constant which is dependent on the dihedral angle in a manner similar to 3JH,H. (The values of 3JC1,H3 proved to be less than 5 Hz in all cases.)
Introduction of a MgH2-based hidride reagent into the field of carbohydrates
During my examinations I usually changed the oxidation states of certain C-atoms in the carbohydrate molecules. To carry out the reductions I introduced a new magnesium hydride based reagent installation into the carbohydrate chemisry.
Organic chemistry is extremely rich in various hydride reagents, which are also very important tools in the field of carbohydrates. The most frequently employed hydrides such as LiAlH4, NaBH4, NaCNBH3 and Bu3SnH, as well as their combinations with various Lewis and protic acids (LiAlH4 - AlCl3, NaCNBH3 - HCl, BH3´ NMe3 - AlCl3) often possess completely new and outstanding properties, and these combined reagents have been successfully applied for the transformation of sugar acetals and orthoesters into hydroxy-ether derivatives.
Concerning the polyfunctional character of carbohydrates, are expected
the employed hydride reagents: i) stereoselectivity, and ii)
compatibility with the different blocking groups of the sugar derivative
under the selected reaction conditions. The present thesis is aimed at
introducing and discussing the scope and limitations of a new complex hydride
reagent prepared in a tribochemical reaction of the autocatalytically produced
magnesium hydride Tego® Magnan with aluminium chloride in
tetrahydrofuran (THF). The composition of this new hydride is dependent
on the molar ratio of the two components:
The main difference between the LiAlH4 - AlCl3 reagent(s) and the present new hydride is that the latter has some ionic character.6 MgH2 + (3+n) AlCl3 + y THF ®
3 [Mg2Cl3(THF)y]+ [AlH4-nCln]- + n Al + n/2 H2
The magnesium hydride based reagent in THF solution is an excellent
tool for the stereoselective reduction of different uloside derivatives.
Sugar azides, primary sulfonyl esters give aminosugars and methylose derivatives
without affecting other functionalities. Halogenated sugars or methylene
derivatives are stable under these conditions. The reagent can be applied
in the presence of a wide variety of blocking groups (acetals, benzyl and
allyl ethers, imides, C=C bonds) generally used in carbohydrate chemistry.
Publications
János Hajkó, Gabriella Szabovik, János Kerékgyártó,
Márton Kajtár and András Lipták: Aust. J.
Chem. 49, 357-363, 1996.
János Hajkó, Anikó Borbás, Gabriella Szabovik,
János Kerékgyártó, Mária Kajtár-Peredy
and András Lipták: J. Carbohydr. Chem. 16 (7),
1123-1144, 1997.
Bajza István, Borbás Anikó, Hajkó János,
Ron Lagas, Szabovik Gabriella, Varga Zsolt, Lipták András:
Magyar Kémikusok Lapja 51, 464-475, 1996.
Gabriella Szabovik, Adél Medgyes, Zsuzsa Antal, Zsolt Varga,
W. Knott and András Lipták: Polish J. Chem.
73, 1003-1009, 1999.
Anikó Borbás, Gabriella Szabovik, Zsuzsa Antal, Pál
Herczegh, Attila Agócs and András Lipták: Tetrahedron
Lett. 40, 3639-3642, 1999.
Anikó Borbás, Gabriella Szabovik, Zsuzsa Antal, Krisztina
Fehér, Magda Csávás, László Szilágyi,
Pál Herczegh and András Lipták: Tetrahedron:
Asymmetry 11, 549-566, 2000.
| Vissza a tartalomjegyzékhez
Back to Contents |
http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |