A gombák szaga
Csaknem tíz évvel ezelőtt jelent meg a hálón a szerző Gombaszagok kémiája című írása. A cikket azóta sokan olvassák, ezért valószínűleg hasznosnak találják majd a folytatást is. (A szövegben szereplő vegyületek képlete megtekinthető a képlet1, képlet2, képlet3 jpg-fájlokban, illetve letölthető a képletek doc-fájlban.)
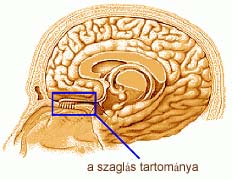
A SZAGLÁS
Az egyik legérdekesebb kérdés, hogy a különböző vegyületek szagát meg lehet-e jósolni szerkezetük alapján. A szaglás jelenleg elfogadott sztereokémiai elmélete szerint a szagérzetet döntő mértékben a szagkeltő anyag molekuláinak geometriája szabja meg. E "kulcs-zár" mechanizmus alapján, amikor a szagkeltő molekula beilleszkedik a megfelelő méretű és alakú receptorhelyre, elindít egy szagérzetet kiváltó impulzust. Az elmélet szerint az azonos alakú molekulák azonos szagérzetet kellene keltsenek, de ez távolról sincs így; sok hasonló alakú molekula szaga nagyon eltér egymástól, míg nagyon eltérő alakú molekulák szaga majdnem egyforma. Például mind a hidrogéncianid, mind a benzaldehid keserűmandula-illatúak annak ellenére, hogy molekuláik nagyon eltérő alakúak; a kamfén nevű szénhidrogén kámforszagú, míg a hasonló alakú dekaborán (ami csak annyiban különbözik a kamféntól, hogy az összes szénatomot bóratomra cseréltük) büdös kénhidrogén-szagú. TURIN (1996) elmélete kiküszöböli a fenti ellentmondásokat, szerinte a szagérzékelő receptorok nem a molekulák alakjára, hanem a molekulák rezgéseire reagálnak, pontosabban kifejezve a molekulák rezgési spektruma az a sajátság, amit az orr detektál és az agy interpretál. Az ötlet első hallásra bizarrnak tűnik, de ha figyelembe vesszük, hogy a másik két érzékünk, a látás és hallás is rezgéseknek és spektrumoknak az agy általi interpretációján alapul, miért ne lehetne ez lehetséges a szaglás esetében is?
 Amerikai
kutatók kimutatták, hogy a jobb orrlyukon belélegzett illatokat általában
kellemesebbnek találjuk azoknál, amelyeket a bal orrlyukon szívunk be (HERZ
et al., 1999). A bal orrlyuk viszont sokkal pontosabban meg tudja különböztetni
egymástól a különböző szagokat. Úgy tűnik, hogy mindegyik orrlyuk az agynak
vele azonos oldalára továbbítja az érzékelési információt. Mivel az agy
jobb oldali feléhez tartoznak az érzelmek, ez megmagyarázhatja, miért találjuk
kellemesebbnek a jobb orrlyukon beszippantott illatokat.
Amerikai
kutatók kimutatták, hogy a jobb orrlyukon belélegzett illatokat általában
kellemesebbnek találjuk azoknál, amelyeket a bal orrlyukon szívunk be (HERZ
et al., 1999). A bal orrlyuk viszont sokkal pontosabban meg tudja különböztetni
egymástól a különböző szagokat. Úgy tűnik, hogy mindegyik orrlyuk az agynak
vele azonos oldalára továbbítja az érzékelési információt. Mivel az agy
jobb oldali feléhez tartoznak az érzelmek, ez megmagyarázhatja, miért találjuk
kellemesebbnek a jobb orrlyukon beszippantott illatokat.
Fontos fejlemény volt a szagreceptorokat alkotó transzmembrán-fehérjecsalád, valamint az azokat kódoló gének felfedezése (BUCK és AXEL, 1991, orvosi-élettani Nobel-díj, 2004). Becslések szerint az emberekben és egerekben egyaránt mintegy 500-1000-re tehető a szaglóreceptorok kialakításáért felelős gének száma, ami azt jelenti, hogy az összes gének 1-2%-a a szaglóérzékhez kapcsolódik!
Patkányokon végzett kísérletekkel kimutatták (RUBIN és KATZ, 2001), hogy a patkányok orra olyan jól van "hangolva", hogy az ember orrával ellentétben szaguk alapján olyan molekulákat is meg tud különböztetni egymástól, amelyek tükörképei egymásnak. (Sok molekula két formában - ún. enantiomerek - létezik, amelyek hasonlóan a jobbkezes és balkezes kesztyűkhez egymás tükörképei, de egyébként teljes mértékben megegyeznek egymással.) Néhány enantiomer szaga olyan mértékben eltér egymástól, hogy az emberi orr is képes megkülönböztetni őket, pl. a karvont egyik formájában kömény-, míg a másik formájában fodormentaszagúnak érezzük. A távoli múltban az embereknek is éles, kifinomult szagérzékük volt, de ellentétben a rágcsálókkal nem voltak rákényszerítve a szaglószerv rendszeres használatára, így az embereknél a szagreceptorokat kódoló gének egykor kiterjedt készletének ma már csak mintegy 60%-a funkcionál.
Sikerült megfejteni azt a rejtélyt is, hogy mily módon képes az orr a szagok sokféleségét interpretálni (MALNIC et al., 1999). Úgy tűnik, hogy az emlősökben a szagérzékelés a szagok felismerésének és feldolgozásának kombinatorikus elvén alapul, ami azt jelenti, hogy ahelyett, hogy egy bizonyos szagnak egy egyedi szagreceptor felelne meg, a szagérzékelő rendszer a receptorok kombinációját használja a szagok kódolására. Ez érthetővé teszi, hogy a mintegy ezer körüli receptor hogyan képes többezer különböző szag leírására. A kémiai szerkezetben előidézett kismértékű változtatások a receptorok különböző kombinációinak aktiválását idézik elő és ennek megfelelően a molekulák különböző szagérzetet keltenek. Így például az oktanol narancs illatú, míg a hozzá hasonló oktánsav izzadtságszagú. Kimutatták azt is, hogy nagyobb mennyiségű szaganyag a receptorok szélesebb köréhez kapcsolódik, mint ugyanannak a vegyületnek kisebb mennyisége. Ez megmagyarázza azt a tapasztalatot, hogy például az egyes gombákban is előforduló indol nagy koncentrációban miért bűzös, míg nyomnyi mennyiségben virágillatú.
 Nagyon szemléletesek
azok a képek, amelyeket mézelő méhek (Apis mellifera) agyában kalciumfüggő
fluoreszcencia optikai úton történő rögzítésével készítettek. Ezzel a technikával
sikerült térben és időben in vivo vizualizálni az agyban a szagok által
előidézett aktivitást (JOERGES et al., 1997). Kimutatták, hogy a méh glomerulusokból
(gomolyag) álló agyában egyrészt az egyes glomerulusokat különböző szagok
aktiválhatják, másrészt az egyes glomerulusok részt vehetnek különböző
szagok aktivitási "térképében". A térben kialakult mintázatok, az egyes
méhek között észlelt individuális eltérések ellenére, a vizsgált szagokra
jellemzőek voltak.
Nagyon szemléletesek
azok a képek, amelyeket mézelő méhek (Apis mellifera) agyában kalciumfüggő
fluoreszcencia optikai úton történő rögzítésével készítettek. Ezzel a technikával
sikerült térben és időben in vivo vizualizálni az agyban a szagok által
előidézett aktivitást (JOERGES et al., 1997). Kimutatták, hogy a méh glomerulusokból
(gomolyag) álló agyában egyrészt az egyes glomerulusokat különböző szagok
aktiválhatják, másrészt az egyes glomerulusok részt vehetnek különböző
szagok aktivitási "térképében". A térben kialakult mintázatok, az egyes
méhek között észlelt individuális eltérések ellenére, a vizsgált szagokra
jellemzőek voltak.
Érdekes eredményre vezetett az a kísérletsorozat, melynek során hímnemű molylepkék "orrára", ami a csápjuk, parányi elektromos regisztrálót rögzítettek és a lepkéket olyan szélcsatornában reptették, amibe nőstény feromonból álló felhőket eregettek be (VICKERS et al., 2001). A szagfelhőkbe való berepülés során kiváltott elektromos jelek analízisekor arra a következtetésre jutottak, hogy a szaglórendszer a "csomagokban" érkező szagok detektálására van optimalizálva. Ez magyarázatul szolgál arra, hogy a szippantás/szimatolás miért javítja jelentős mértékben a szagérzékelést. Az illatszeriparban professzionálisan szaglással foglalkozó szakemberek például a minták szaglása során kezükkel illatfoszlányokat terelgetnek maguk felé "a megfelelő koncentráció előállítása céljából". Ez a kutatási eredmény alátámasztja a gombák szaglására javasolt, tapasztalati tényeken alapuló módszert, mely szerint a gombát többször, rövid időközökkel megszakított lélegzetvétellel célszerű körülszaglászni.
Jelentős erőfeszítések történtek a szagok detektálására és mérésére alkalmas "elektronikus orr" kifejlesztésére is (GARDNER és BARTLETT, 1999). Az "elektronikus orr" olyan műszer, ami elektronikus kémiai szenzorok megfelelő elrendezéséből áll és képes egyszerű vagy komplex szagok felismerésére. A kereskedelmi forgalomban is kapható szagfelismerő berendezésekben kémiai szenzorként fém-oxidokat, lipidrétegeket, vezető polimereket, szerves félvezetőket stb. alkalmaznak.
A GOMBÁK SZAGÁRÓL GOMBÁSZ SZEMMEL
A "mikológia atyja"-ként számontartott Elias Magnus Fries (1794-1878) soha nem említette gombaleírásaiban a gombák szagát (XANDERS, 1991). Ez érthetővé válik, ha tudjuk, hogy Fries nagyon erősen tubákolt, ami a szaglását tönkretette. A későbbi híres gombászok, mint például a francia Quélet, Patouillard és Maire, a gombák szagát azok fontos jellegzetességeként értékelték. Heim a gombaszagokat négy csoportba osztotta: a mindig kellemes és enyhe virág-gyümölcs illatok; a kifejezett és gyakran nagyon intenzív fűszeres illatok; a rothadó szagok (büdös, kellemetlen, gyakran nagyon feltűnő); specifikus szagok. A legtöbb esetben a gomba szaga a legkifejezettebb a lemezeknél, illetve a csöves termőrétegnél. Ha a szag csak a tönk bázisánál érezhető, azt jelenti, hogy a szaganyag tulajdonképpeni hordozója a micélium. A gomba szaga a termőtest korától, húsának nedvességtartalmától, valamint a levegő hőmérsékletétől függően különböző lehet. Ha a gyűjtés során csak nagyon kisméretű termőtesteket találunk, érdemes azokat egy műanyagzacskóba zárni majd a zacskót rövid idő múlva óvatosan kinyitni: ekkor a gomba szaga nagyon jól érezhetővé válik. Néhány gomba (pl. ízletes vargánya, kucsmagombák) jellegzetes szaga főleg szárítás során jelentkezik. A szarvasgombákból a fejlődési fázisuk végén, röviddel mielőtt a termőtestjeik elkezdenek szétesni, áramlanak ki a nagyon intenzív szaganyagok, amelyek a felettük lévő földrétegen áthatolva izgatják a különféle állatok szaglószerveit.
A gombák szaglással történő azonosításának megbízhatóságát tárgyalja a borászatból és mikológiából vett példák alapján NEVILLE (1999). Az alábbi kísérlet jól érzékelteti, hogy a szaglás eredményét nagymértékben befolyásolhatják külső körülmények: fehér bort megfestettek vörös szagtalan színezékkel és a "kétfajta" bort két hét eltéréssel 54 kísérleti alannyal megszagoltatták. A vörös festékkel megszínezett bor esetében feketeribizli/szilva illatot véltek felfedezni! A gombát szagló személy korábbi tapasztalata, gyakorlata is befolyásolja, hogy az illető milyen jelzőt használ a gomba szagának jellemzésére. Nem szabad azt sem elfelejteni, hogy a gomba szaga jelentős mértékben változhat a gomba termőtestének fejlődése folyamán, valamint a gomba leszedése után eltelt idő függvényében is. Így például azt észlelték, hogy a Cortinarius atrovirensnek a termőhelyen észlelt jellegzetes körteilllata estére narancsvirág/égetett cukor illatúra változott, majd másnap reggelre ismét visszatért a gomba körteillata. A felsorolt példák is felhívják a figyelmet a szagérzékelés szubjektív voltára és arra, hogy a gomba szagának szerepét nem szabad túlértékelni a gombahatározás során, a szagot is csak egy, ugyan fontos, tulajdonságnak kell tekinteni a gombafajt jellemző többi sajátság között.

Macrocystidia cucumis (uborkaszagú szemétgomba)
http://www.in2.dk/fungi/imageframe1.htm
A Field Mycology című folyóirat már a második számában foglalkozik a gombák szagával (WOODALL, 2000). A cikkben a szerző felsorol mintegy nyolcvan, általa jellegzetesnek vélt gombaillatot, rábízva az olvasóra annak kitalálását, hogy ezekhez az illatokhoz mely gombák tartoznak. A szag-"megfejtésekből" (a legjobb megfejtőt a szerkesztőség könyvvel jutalmazta) kiemelnék néhány különlegesebb példát (KIBBY, 2000; WOODALL, 2000). "egérürülék": Entoloma incanum (zöldes pitykegomba), "vidratrágya" (ami hal és uborka szagának keveréke): Macrocystidia cucumis (uborkaszagú szemétgomba), "lábszag": Cortinarius camphoratus, "fogpor": Lentinus lepideus (pikkelyes fagomba), "utcalány" (olcsó szappan!): Tricholoma saponaceum (szappanszagú pereszke) és végezetül "begerjedt koca": Cortinarius vulpinus.
Nagyon tanulságos az interneten található "gomba-tanóra" anyaga (MITCHELL, 1999). A gomba adatfájl 8124 gyűjtött gombáról tartalmaz információt, minden gomba 23 "változóját" mérték meg. A legtöbb változó a gomba alakján, méretén, színén és szagán alapult, míg egy változó, az "ehetőség" azt méri, hogy a gomba ehető vagy mérgező. A tanóra célkitűzése az volt, hogy az adathalmaz analízisével megállapítsák, mely változók különböztetik meg legjobban az ehető gombákat a mérgezőktől. Az analízis arra a meglepő eredményre vezetett, hogy a gomba szaga a gombának az a tulajdonsága, ami alapján az osztályozás a legsikeresebben elvégezhető. A kilenc szagosztály mindegyike – kivéve a szagtalan gombákat – vagy mérgező (dohos, fenol-, szúros, visszataszító, hal-, fűszeres szagúak) vagy ehető (ánizs-, mandulaillatú) gombákat tartalmazott. A szagtalan gombák esetében, amelyeknek egyébként 96,6%-a ehető volt, a legjobb osztályozó tulajdonságnak a tönk alakja bizonyult: az összes keskenyedő tönkű gomba ehető volt, míg a kiszélesedő tönkkel rendelkező gombáknak csak 88,37%-a. Ezeknek a gombáknak a további osztályozása a spóraszín alapján történhet.
A GOMBÁK SZAGÁT ELŐIDÉZŐ VEGYÜLETEK
A gombák szagát előidéző vegyületek azonosítására alkalmazott egyik, általánosnak tekinthető módszer abban áll, hogy a gombából különböző szerves oldószerekkel (diklórmetán, etiléter) kioldják az illékony vegyületeket, majd gázkromatográfon elválasztják őket egymástól, végezetül a szétválasztott komponenseket tömegspektrométeres analízisnek vetik alá. Az egyes komponenseknek a gázkromatográfon eltöltött idejét (ún. retenciós idő) és tömegspektrumát összehasonlítva szintetikus úton előállított autentikus, tiszta vegyületekével lehetővé válik a szagkomponensek azonosítása. Egy másik módszer az ún. "gőztér-analízis", amelynek lényege, hogy a friss termőtestet légmentesen bezárják egy üvegedénybe, majd egy injekcióstűvel ellátott fecskendővel mintát vesznek a gomba feletti légtérből, amit gázkromatográfiás-tömegspektrométeres technikával analizálnak. Ennek a módszernek egyik változatában (OVERTON és MANURA, 1999) a gombát tartalmazó üvegedényt száraz gázzal öblítik át, majd a gázból az illékony vegyületeket műgyantán megkötik, végül a műgyantáról felmelegítéssel felszabadított vegyületeket gázkromatográfiás-tömegspektrométeres módszerrel azonosítják. Érdekességként megemlítem, hogy a mérések szerint az Agaricus campestris (kerti csiperke) sokkal gazdagabb ízanyagokban, tehát "ízletesebb", mint az Agaricus bisporus (termesztett csiperke). A különböző szerzők sok esetben ugyanabban a gombafajban részben különböző illékony anyagokat találtak, aminek egyik magyarázata az alkalmazott analitikai módszerek különbözőségében rejlik.

Agaricus campestris (kerti csiperke)
http://www.in2.dk/fungi/imageframe1.htm
A Hebeloma sacchariolens (illatos fakógomba) illatát erősen édes, aromás, gyümölcs-, narancsvirág- vagy amilacetát-szagként írják le. Ez az illat egyébként nem gyakori gombák esetében. Egyértelműen megállapítható volt (WOOD et al., 1992), hogy a gomba szaga a 2-aminobenzaldehidtől származik, ami egyébként néhány virág kellemes illatát előidéző illatanyagok főkomponense is.
A pitykegombák közül kitűnik jellegzetes "cukorka"- ("tutti-frutti") illatával a Nolanea fructufragrans, amely a gomba 1,3-dimetoxibenzol-tartalmától származik (LARGENT et al., 1990). A gomba másik illékony komponense, a kis mennyiségben (12%) jelen lévő anizol aromás szagát teljes mértékben elfedi az 1,3-dimetoxibenzol illata. Ezt a vegyületet korábban már az Entoloma icterinumban (citromsárga pitykegomba) is izolálták (SCHMITT és KLOSE, 1973). Noordelos szerint a gomba illatának intenzitása nagy változatosságot mutat és ezért nem lehet használni mint karakterisztikus elválasztó bélyeget a morfológiailag hasonló, de szagtalan Entoloma pleopodiumtól, ezért az E. icterinumot az E. pleopodium szinonimájaként írja le (NOORDELOOS, 1980). Miután ma már pontos kémiai módszerekkel ki lehet mutatni a gombában az 1,3-dimetoxibenzol jelenlétét, a szaganyagot produkáló E. icterinum és a szagtalan E. pleopodium szinonimaként történő kezelése megkérdőjelezhető.
Igen tanulságosak és érdekesek az Agaricus augustus (óriás csiperke) illatával kapcsolatos vizsgálatok (WOOD et al., 1990). Egyes leírások szerint a gomba mandula-, mások szerint ánizsillatú. A két szaghoz kapcsolható vegyületek teljes mértékben eltérnek egymástól: ánizsillata az anetolnak van, míg a keserűmandula-illat sok esetben benzaldehidtől származik. A gombában talált illékony vegyületek 41% benzaldehidet, 54% benzilalkoholt és 3% 4-hidroxibenzaldehidet tartalmaznak, tehát ánizsszagot előidéző anetolt nem találtak. Ezek közül a két főkomponens mandulaszerű illatú, míg a harmadik összetevő szagtalan. A benzaldehidből és benzilalkoholból négy olyan keveréket készítettek ásványolajban történő feloldással, amelyekben a két vegyület aránya megegyezett a gombában találttal, de az egyes elegyek koncentrációja mindig tízszerese volt az előzőnek. Meglepő módon a 38 személyből álló "szagtestület"-ből már a középső két koncentrációjú elegyet hatan ánizsszagúnak észlelték, míg a legtöményebb elegy esetében 16-an állították azt, hogy ánizsszagot éreznek. Ebből a kísérletből megállapítható, hogy miután az egyes személyek a két vegyületből álló keverék szagát igen eltérő módon ítélik meg, az óriás csiperke szagának leírására alkalmazott mindkét jelző (mandulaszagú, ánizsszagú) pontosnak tekinthető.

Hydnellum suaveolens (ánizsszagú gereben)
Dr. Robert Thomas © California Academy of Sciences
A Hydnellum suaveolenst (ánizsszagú gereben) erős illata, amelyet aromásnak, gyengén fahéjszerűnek, ánizs-, borsmenta-, ánizsaldehid-, kumarinszagúnak írnak le a különböző szerzők, jól megkülönbözteti a többi kék- vagy ibolyás árnyalatú Hydnellum fajtól. A friss gomba illatanyagainak kémiai vizsgálata azt mutatta, hogy azok 30% p-ánizsaldehidet és 62% kumarint tartalmaznak (WOOD et al., 1988). Megfigyelték, hogy a lefagyasztott gomba szaga jelentősen megváltozott, amikor a felolvasztás után néhány órát szobahőmérsékleten állt; a kémiai analízis során a fenti két vegyület helyett a gombában két új vegyületet találtak, amelyek a p-ánizsaldehid, kumarin metabolitikus átalakulásával keletkeztek. A p-ánizsaldehidből és kumarinból készített elegyek szagának a gomba szagával történő összehasonlítása világosan megmutatta, hogy egyes személyek jobban érzékelik a p-ánizsaldehid, mint a kumarin szagát, míg mások esetében ez éppen fordítva van. A szagfelismerésben észlelt különbségek megmagyarázzák a gomba szagának leírására használt különböző jelzőket. A vizsgálatok arra is felhívják a figyelmet, hogy a gomba szagát előidéző vegyületek változhatnak a fagyasztás után, ezért is fontos, hogy a gomba szagát mindig még a helyszínen feljegyezzük.
A Tricholoma inamoenum kátrány-, vagy mások szerint világítógázszaga gyakran segít a gomba azonosításában. Papír- és szilikagél-kromatográfiás technikával HILBER (1968) azt találta, hogy ezt a jellegzetes szagot indol és/vagy szkatol idézi elő. Gázkromatográfiás-tömegspektrometriás vizsgálatok viszont azt mutatták, hogy az illékony vegyületek főkomponensei 1-oktén-3-ol, benzaldehid és fenilacetaldehid, és ezek keverékéből származik a kátrányszag (WATSON et al., 1986). Indolt szintén találtak nagyon kis mennyiségben (szkatolt viszont nem), és a fenti vegyületekből előállított elegyek szaglásával megállapították, hogy az indol nem járul hozzá a gomba jellegzetes kátrányszagához.

Leucopaxillus gentianeus (keserű álpereszke)
http://www.in2.dk/fungi/imageframe1.htm
A "lisztszag"-ot úgy lehet jellemezni, mint ami a "frissen őrölt durva liszt" szagához hasonlít. Ezt a típusú gombaszagot három kategóriába lehet osztani (MOSER, 1983): a/ lisztes, b/ uborka/lisztes és c/ avas, olajos vagy halszagú/lisztes. A lisztes szagért felelős vegyületek ismeretlenek, de az uborka szagát előidéző vegyületeket azonosították transz-2-nonenal- és transz, cisz-2,6-nonadienalként (l. pl. FORSS et al., 1962). Azt is megállapították, hogy ezek a vegyületek az uborka szöveteinek széttörése során képződnek nagy sebességgel linolsavból és linolénsavból. A "lisztszagú" gombák három csoportjába tartozó hat faj ( a/ Entoloma madidum (kékes döggomba), Leucopaxillus gentianeus (keserű álpereszke), b/ Clitopilus prunulus (kajsza lisztgomba), Catathelasma ventricosa és c/ Nolanea sericea (fehér pitykegomba), Nolanea hirtipes) vizsgálata azt mutatta, hogy transz-2-nonenal csak az uborkaszagú alcsoportba tartozó gombákban (Clitopilus prunulus (kajsza lisztgomba) és Catathelasma ventricosa) található (WOOD et al., 1994). Trans, cisz-2,6-nonadienalt viszont egyik vizsgált gombában sem találtak. Miután linolsavat is kimutattak a fenti két gombafajban, feltételezhető, hogy a transz-2-nonenal az uborkában lejátszódó bioszintetikus folyamatokhoz hasonlóan képződik a gombákban is. Érdekes megfigyelés, hogy mind a hat vizsgált fajban jelentősen megnőtt az illékony komponensek száma, valamint a szag intenzitása, ha vizsgálat előtt a gombát szétmorzsolták. Ebből arra lehet következtetni, hogy a lisztes szagért felelős, mindmáig ismeretlen vegyületek generálásában fontos szerepet játszik a gombaszövet széttörése.
A Lactarius helvus (daróc-tejelőgomba) szaga megszáradva intenzív, cikóriára és szénára emlékeztető. A gomba illékony anyagainak (0,04% a szárazanyagra vonatkoztatva) analízise során 38 komponenst találtak, legnagyobb mennyiségben kaprilsavat (25,6%), 3-amino-4,5-dimetil-2(5H)-furanont (15,8%) és 2-metil-vajsavat (12,9%) (RAPIOR, FONS et al., 2000). Megállapították, hogy a gomba jellegzetes szagát az illékony vegyületek között mindössze 1,4%-ban jelenlévő 3-hidroxi-4,5-dimetil-2(5H)-furanon, más néven szotolon idézi elő. Egyébként a szotolon az egyik legfontosabb, nagyértékű ízesítőanyagként használt vegyület, amit dohány ízesítésénél, mesterséges juharfaszirup előállításánál és curry készítésénél széleskörűen alkalmaznak.
A dohos-földes szagú gombák jellegzetes képviselői a Cortinarius
herculeus, Cystoderma amianthinum (sárga őzlábgomba) és Cystoderma
carcharias (erősszagú őzlábgomba). A gombák jellegzetes szagát egy
szeszkviterpén-származék, a geozmin (1,10-transz-dimetil-transz-9-dekalol)
idézi elő (BREHERET et al., 1999). Az irodalomból jól ismert, hogy ennek
a vegyületnek jellegzetes dohos-földes szaga van és rendkívül alacsony
a szagküszöbértéke (0,1 ppb!). Geozmint már korábban is találtak különféle
gombák illékony anyagai között, de ez az első eset, hogy Basidiomycota
metabolitokból való képződését észlelték.
 |
 |
 |
A Laetiporus sulphureus (sárga gévagomba) háromféle változatban
http://www.in2.dk/fungi/imageframe1.htm
A Laetiporus sulphureus (sárga gévagomba) szagát különböző szerzők különféle jelzőkkel illetik: "többé-kevésbé kellemes", "gombaszagú", gyakran "dohos", míg egyesek szerint a gomba öregedése során "kellemetlen szagúvá" válik. A gomba 26 azonosított illékony komponensének 11,5%-a szagos (RAPIOR, KONSKA et al., 2000), amelyekből néhány a gomba kellemes illatához járul hozzá, mint például a: 2-feniletanal (virág), 2-feniletanol (rózsa), benzaldehid és benzoesav (keserűmandula). A gomba öregedése során kialakuló kellemetlen szagot kéntartalmú vegyületek, mint pl. 3-metiltiopropanal okozzák. Zárójelben megjegyzendő, hogy a gomba fiatalon, pl. pörkölt formájában ehető (erre utal angol közönséges neve "erdők csirkéje"), de öregen szívóssá válik, sőt Kanadában fogyasztása súlyos megbetegedést is okozott egy gyereknél (APPLETON et al., 1988).
A gyümölcsbor-illatú Agrocybe aegerita (déli tőkegomba) 31 illékony komponense között legnagyobb számban a nyolc szénatomot tartalmazó vegyületek fordulnak elő, azok között is legnagyobb mennyiségben a "gomba-gyümölcs" illatú 3-oktanon (RAPIOR et al., 1998). Nagy mennyiségben észleltek továbbá 3-hidroxibutan-2-ont (éter-gyümölcs illat) valamint 2-metilbutanolt ("tejcsarnok"-szag), amelyek feltehetően szerepet játszanak a friss gomba "borseprő"-aromájának kialakításában.
A Földközi-tenger és az Atlanti-óceán partjainak homokdűnéin igen elterjedt Gyrophragmium dunalii szagát "Agaricus bisporus"-illatú, "cián", "keserűmandula ánizs mellékillattal" jelzővel jellemzik az irodalomban. A két lelőhelyről gyűjtött példányok illékony komponenseinek analízise azt mutatta, hogy a harminc azonosított vegyületből legnagyobb mennyiségben a benzaldehid (44,2, ill. 28,0%) és a benzilalkohol (11,0, ill. 38,6%) található (RAPIOR et al., 2001). A Gyrophragmium dunalii keserűmandula/ánizs szagáért felelős fenti két vegyület jelenléte, valamint az, hogy a gomba pozitív Schäffer-reakciót ad (a gomba húsát anilinnel és tömény salétromsavval érintkezésbe hozva narancsszínű elszíneződés lép fel) valószínűsíti rokonságát a Flavescentes szekcióba tartozó csiperkefajokkal. (A keserűmandula-illatú benzaldehidet széleskörűen használják az élelmiszer- és kozmetikai iparban.)

Tricholoma sulphureum (büdös pereszke)
http://www.in2.dk/fungi/imageframe1.htm
A Tricholoma sulphureum (büdös pereszke) világítógázszagát indoltartalmának tulajdonították (HILBER, 1968), amit megerősítettek a legújabb vizsgálatok is, ezek szerint a világítógázszagot az indol és 3-formilindol okozhatja (RAPIOR et al., 1998).
Annak ellenére, hogy több közlemény (pl. MAGA, 1976)) foglalkozik a fűszergombaként is használatos Marasmius alliaceus (sötéttönkű fokhagymagomba) micéliumának szilárd és folyékony tápközegben való tenyésztése során észlelt fokhagymaszagával, kevés információ áll rendelkezésre arra vonatkozóan, hogy mely illékony vegyületek okozzák a fokhagymaszagot. A gomba illékony vegyületeinek igen alapos analízise kimutatta, hogy a fokhagymaszerű szag hat vegyülettől ered: a főkomponensként jelenlévő dimetildiszulfidtól, dimetiltriszulfidtól és 2,3,5-tritiahexántól, valamint a kisebb koncentrációban található dimetiltetraszulfidtól, ciklohexilizocianáttól és 3,4-ditiahexántól (RAPIOR, BREHERET et al., 1997). A nem elhanyagolható mennyiségben jelenlévő benzaldehid és 3-metilbutanal (gyümölcsillatú) szintén részt vesz a gomba aromájának kialakításában. A Marasmius alliaceushoz (latinul allium - fokhagyma, aceous - hasonló) hasonlóan fokhagymaszagú még a Marasmius scorodonius (barnatönkű fokhagymagomba) és a Marasmius prasiosmus (nagy fokhagymagomba) is.
A Coprinus picaceus (harkály tintagomba), különösen a még nem kifejlett példányok szaga meglehetősen kellemetlen és nagyon hasonlít a szkatol jól ismert szagához. (A szkatolt széleskörűen használják a parfümiparban, megtalálható a természetben is néhány növényben, valamint a cibetmacska mirigyváladékának egyik összetevője, ezenkívül jelen van minden ürülékben. Ez jól illusztrálja, hogy az illatanyagok szaga drasztikusan változhat a szaganyag koncentrációjával.) A gombából extrahált anyagok gázkromatográfiás-tömegspektrométeres, valamint vékonyréteg-kromatográfiás analízisével kimutatták, hogy a Coprinus picaceus tönkjének kellemetlen szaga valóban a szkatoltól származik, ami sokkal intenzívebb, mint a kis mennyiségben szintén jelenlévő indol ( LAATSCH és MATTHIES, 1992).
A világ legdrágább ételei közé tartozó szarvasgombák illatanyagainak kémiai összetételét feltehetőleg régóta analizálják különböző ipari laboratóriumokban. Ennek ellenére csak néhány cikk található ezzel kapcsolatban az irodalomban (az 1990 előtt megjelent cikkek eredményeit PACIONI és mtsai (1990) foglalták össze). A kereskedelmi forgalomban kapható "szarvasgomba-ízesítők" szaga korántsem egyezik meg a friss szarvasgomba illatával. A szarvasgomba-konzervekben gyakran találtak dietilszulfidot, amit a szarvasgomba illatanyagainak hamisítására használnak. A fekete téli szarvasgombák csoportjába tartozó fajok (Tuber melanosporum (francia szarvasgomba), Tuber brumale (téli szarvasgomba), Tuber brumale var. moschatum és Tuber hiemalbum (tavaszi szarvasgomba)) illatanyagait gőztér-analízis technikával tanulmányozták PACIONI és mtsai (1990). A téli szarvasgombák szaganyaga tizenegy vegyület keverékéből áll, legnagyobb mennyiségben minden minta gőzterében dimetilszulfidot találtak, ami a szag fő előidézőjének tekinthető. A négy vizsgált faj szaganyag-összetételében nem találtak minőségi különbséget, de az egyes illékony komponensek relatív mennyisége különböző volt, ami egyrészt hozzájárulhat ahhoz, hogy az ember orra képes különbséget tenni a fajok között, másrészt kemotaxonomiai szempontból is jelentőséggel bírhat. A korábbi vizsgálatok (NEY és FREYTAG, 1980; TALOU et al., 1987) eredményei mind kvalitatíve, mind kvantitatíve jelentősen eltérnek a jelen eredményektől. Ez azzal magyarázható, hogy míg PACIONI és mtsai (1990) a termőtest által kibocsájtott illatanyagokat vizsgálták, addig az előbbi két szerzőcsoport, amely például lényegesen kevesebb dimetilszulfidot talált, a termőtestben található vegyületeket analízálta. Az ehető szarvasgombák között a Tuber mesentericum (nyári szarvasgomba) kitűnik kellemetlen, erős, fenolos (petróleum) szagával. Kémiai szempontból ez a szarvasgombafaj az előzőektől abban tér el, hogy 2-metil-1,3-butadien (izoprén) és m-metilanizol is található a szaganyagok között (PACIONI et al., 1991). A 18 vizsgált mintából azonban csak 12-ben találtak a fenolos szagért felelős m-metilanizolt, a szagtalan gombákban nem képződött ez a vegyület. A gombák között egyébként nem észleltek semmiféle morfológiai különbséget, ami azt jelzi, hogy két különböző "kemofaj" létezhet.
A gőztér gázkromatográfiás – ioncsapdás tömegspektrometriával kombinált, szilárd fázisú mikroextrakciós módszerrel történő vizsgálata kiválóan alkalmasnak bizonyult a "fehér szarvasgomba" (Tuber magnatum (piroshúsú szarvasgomba)) és a Tuber melanosporum (francia szarvasgomba) aromaanyagaiban található illékony szerves kénvegyületek detektálására (PELUSIO et al., 1995). Mindkét faj esetében megtalálták a korábbi vizsgálatok során azonosított összes vegyületet, a Tuber magnatum aromaanyagában három (dimetildiszulfid, dimetiltriszulfid és 1,2,4-tritiolan), míg a Tuber melanosporum esetében két (1-(metiltio)propán és 1-metiltio-1-propén) új kénvegyületet találtak. A fekete szarvasgomba aromájában a domináns kénvegyület a dimetilszulfid, míg a fehér szarvasgomba aromájáért a dimetilszulfid és bisz(metiltio)metán a felelős. A fekete szarvasgomba szeletek kifejezetten gombaszagúvá válnak a kénvegyületek elillanása után, ami a fekete szarvasgombában található jelentős mennyiségű 1-okten-3-ol és más nyolcatomos szénvegyületeknek tulajdonítható.

Clathrus ruber (piros kosárgomba)
http://www.in2.dk/fungi/imageframe1.htm
Régóta ismert, hogy a gombák terjedésében, így például a vörös festékanyagokat tartalmazó Clathrus ruber (piros kosárgomba) és Anthurus archeri (tintahalgomba) esetében, fontos szerepet játszanak a gombák élénk színe, valamint szaga által odavonzott legyek. A Phallus impudicus (erdei szömörcsög) nem tartalmaz vörös pigmenteket, de ezt "pótolja" sokkal erősebb "dögszagával", amely már messziről jelzi jelenlétét az erdőben. Ezeknek a gombáknak szag- és festékanyagairól alapos összefoglaló olvasható STIJVE (1999) munkájában. Az erdei szömörcsög szaga egyes fejlődési szakaszaiban különböző (pl. a boszorkánytojás torma/retek szagú), ami a szerzőt többek közt arra a feltételezésre vezette, hogy a szaganyagok a glebában jelenlévő glükozidok folyamatos, enzimatikus felhasadása révén keletkeznek. Ezt alátámasztja az a megfigyelés, hogy alacsony hőmérsékleteken (0 – 5 oC) gyakran lehet találni szagtalan szömörcsögöt. Ezeken a hőmérsékleteken ugyanis a szagképző vegyületek keletkezése jelentősen lelassul, mivel az enzimatikus folyamatok optimális hőmérséklete jóval 10 oC fölött van. További bizonyíték erre a hipotézisre az a megfigyelés (KLAASSEN, 1964), hogy a megszárított erdei szömörcsög szaga regenerálható benedvesítéssel, ami az enzimek újraaktiválásával magyarázható. Sajnos mind a mai napig nem történt kísérlet a gombában található enzimek izolálására. A kilencvenes években újra foglalkozni kezdtek az erdei szömörcsög szaganyagaival, ugyanis három svéd kutató észrevette, hogy a trópusokon élő gyíkfarokfű (Sauromatum guttatum) virágzatának szaga nagyon hasonlít az erdei szömörcsögéhez (BORG-KARLSON et al., 1994). Megállapították, hogy a növény, hasonlóan az erdei szömörcsöghöz, dögszagkomponensekként túlnyomórészt metilszulfidokat (melyek közül a dimetiltriszulfid a legfontosabb) tartalmaz. Természetesen a két organizmus által termelt szaganyagok nem mindenben egyeznek meg, például a gyíkfarokfű szaganyagai között megtalálható az ürülékszagú indol és szkatol, míg az erdei szömörcsög legnagyobb mennyiségben termelt szaganyaga a transz-ocimén nem található meg a virágban. Mind a virág, mind a gomba ugyanabba a nemzetségbe tartozó döglegyeket vonzza, amiben feltehetőleg a metilezett szulfidok játsszák a fő szerepet, hiszen ezek a vegyületek az állati fehérjék bomlása során is képződnek. Az erdei szömörcsög szaganyag-összetételére vonatkozó eredmények jelentős mértékben eltérnek az 1968-ban végzett korábbi vizsgálatétól (LIST és FREUND, 1968). Valószínűnek tűnik, hogy a svéd kutatók eredményei megbízhatóbbak, az általuk alkalmazott modern technika sokkal nagyobb teljesítőképessége következtében. A Clathrus ruber (piros kosárgomba) főzőpohár alatt tartásával, majd az üveg falán adszorbeált szaganyagok leoldásával és analízisével dimetildiszulfidot, dimetiltriszulfidot, transz-ocimént, linaloolt és ecetsavat mutattak ki (STIJVE, 1999). A kéntartalmú vegyületek mennyisége lényegesen kisebb a többi szagkomponensénél, ami érthetővé teszi, hogy a piros kosárgomba szaga miért kevésbé penetráns mint az erdei szömörcsögé.
ÍZESÍTŐANYAGOK ELŐÁLLÍTÁSA GOMBÁKBÓL
Az élelmiszeriparban kiterjedt kutatás folyik különböző ízesítőanyagok fermentációs termékekből történő előállítására. A "merítéses fermentáció" (submerged fermentation) gyors és jól irányítható technikának tűnik nagy aromatartalmú gomba-biomassza előállítására, amely ráadásul nem olyan idő- és munkaigényes, mint a termőtestképzéssel járó tradicionális módszerek. HADAR és DOSORETZ (1991) cikkükben összefoglalták az ízanyagban gazdag ehető gombák ilyen technikával történő előállítására vonatkozó kutatási eredményeket, valamint részben a gombák illékony anyagaival és biokémiai képződésével is foglalkoznak. A technika jövőbeni széles körű alkalmazása azon múlik, hogy sikerül-e a gombamicéliumból álló biomasszában az ízanyagok mennyiségét jelentős mértékben megnövelni.

Sparassis crispa (káposztagomba)
http://kinoko-ya.jp/01eng/sparassis_crispa01.htm
Egy ilyen irányú vizsgálatban ( KAWABE és MORITA, 1993) különböző ehető gombák, többek közt Polyporus tuberaster (olaszgomba), Pleurotus cornucopiae (erestönkű laskagomba), Sparassis crispa (káposztagomba), Pleurotus ostreatus (késői laskagomba), Cortinarius purpurascens (bíborlila pókhálosgomba), 117 törzsét tenyésztették folyékony tápközegben és leszűrés után a tápközeg szagát egy tíz tagból álló csoport minősítette. A legjobbnak a virág-, kissé fahéjszerű illatot produkáló Polyporus tuberaster K2606-ot találták. A tápközegben 47 vegyületet azonosítottak, amelyek közül legnagyobb mennyiségben (8 ppm) az illékony anyagok 61%-át kitevő benzaldeid fordul elő. A 26%-ban előforduló 3-metil-1-butanol mellett természetesen a kisebb mennyiségben jelenlévő illékony vegyületek is jelentős szerepet játszanak a gomba aromájának kialakításában: benzaldeid, benzonitril (mandulaszag), acetofenon (édes, kissé szúros szag), benzilalkohol (gyenge gyümölcsillat), 2-feniletanol, 2-fenilpropanol és 3-fenilpropanol (virágillat). A tápközeghez L-fenilalanint adagolva jelentősen nőtt a gomba által termelt benzaldeid és benzylalkohol mennyisége (KAWABE és MORITA, 1994).
Régóta ismeretes (l. például JANCSÓ, 1990), hogy a gombák jellegzetes
"gombaszag"-át előidéző fő illékony komponens az 1-okten-3-ol ("gomba-alkohol").
A vegyület képződése a gombában három lépésben játszódik le (l. például
HADAR és DOSORETZ, 1991): a/ szabad zsírsavak (főleg linol- és linolénsav)
képződése lipidek hidrolízise révén acilhidroláz enzim segítségével, b/
az így képződött többszörösen telített zsírsavak hidroperoxidácója, amely
folyamatban a kulcsszerepet a lipoxigenáz enzim játssza, c/ a harmadik
lépésben, a hidroperoxidok felhasadásában, az előbbi enzim mellett más
enzimek is szerepet játszanak (pl. hidroperoxid-liáz, alkohol-dehidrogenáz).
A linolsav és linolénsav enzimatikus átalakulása során képződő nyolc- és
tízatomos szénvegyületeket az Agaricus campestris (kerti csiperke)
friss termőtestjeiből kiextrahált aromakoncentrátumban azonosították (TRESSL
et al., 1982). Ha az extraháláshoz használt foszfát-pufferhez linolsavat
adtak, akkor a gomba keveréssel történő homogenizálása során a nyolc szénatomos
vegyületek koncentrációja jelentősen megnőtt, ami alátámasztja, hogy a
linolsav ezen vegyületek természetes prekurzora. Az 1-okten-3-ol termesztett
csiperkében (Agaricus bisporus) történő enzimatikus képződésének
vizsgálata során megállapították, hogy a lipoxigenáz és hidroperoxid-liáz
enzimek optimális aktivitása 5,0-7,0 pH-tartományban található (MAU et
al., 1992). Érdekes az az eredmény is, hogy a termesztési ciklus során
a gomba 1-okten-3-ol-koncentrációja a 19,3-37,2 ppm tartományban változott,
továbbá, hogy jelentősen több képződött ebből az illatanyagból a lemezekben,
mint a gomba többi részében. Ez összhangban van azzal a korábbi észleléssel
(BERNHARD és SIMONE, 1959), amely szerint szignifikáns eltérés van a tönk
és a lemezek, valamint a kalap és a lemezek aromaintenzitásában, de nincs
a kalap és tönk között. Megállapították azt is, hogy a gomba tárolása során
az enzimaktivitás, valamint az 1-okten-3-ol mennyisége drasztikusan csökken.
IRODALOM
ANDRIST M. (2000): Nasweisheiten. Schweiz. Z. Pilzkunde 78: 238-240.
APPLETON R.E., JAN J.E., KROEGER P.D. (1988): Laetiporus sulphureus
causing visual hallucinations and ataxia in a child. CMAJ 139: 48-49.
BERNHARD R.A., SIMONE J.J. (1959): The locus of aroma in the mushroom
(Agaricus campestris L.) Food Res. 26: 165.
BORG-KARLSON A.K., ENGLUND F.O., UNELIUS C.R. (1994): Dimetil oligosulphides,
major volatiles released from Sauromatum guttatum and Phallus impudicus.
Phytochemistry 35: 321-323.
BREHERET S., TALOU T., RAPIOR S., BESSI?RE J.-M. (1999): Geosmin, a
sesquiterpenoid compound responsible for the musty-earthy odor of Cortinarius
herculeus, Cystoderma amianthinum, C. carcharias. Mycologia 91: 117-120.
BUCK L., AXEL R. (1991): A novel multigene family may encode odorant
receptors: a molecular basis for odor reception. Cell 65: 175-187.
CUCCHI I. (2000): Der Duft der grossen, weiten Pilzwelt. Schweiz. Z.
Pilzkunde 78: 201.
FORSS D.A., DUNSTONE E.A., RAMSHAW E.F., STARK W. (1962): The flavor
of cucumbers. J. Food Sci. 27: 90-93.
FORTE J. (1999): Les odeurs chez les Cortinaires. Bull. Fédér. Ass.
Mycol. Médit., N.S. 16: 3-12.
GARDNER J.W., BARTLETT P.N. (1999): Electronic noses: principles and
applications. Oxford University Press, Oxford.
GROSS B., ASTHER M. (1989): Arômes de basidiomyc?tes: caractéristiques,
analyses et productions. Sciences des Aliments 9: 427-454.
HADAR Y., DOSORETZ C.G. (1991): Mushroom mycelium as a potential source
of food flavour. Trends in Food Science and Technology 2: 214-218.
HERZ R.S., McCALL C., CAHILL L. (1999): Hemisperic lateralization in
the processing of odor pleasantness versus odor names. Chem. Senses 24:
691-695.
HILBER O. (1968): Indol als Hauptkomponente des Geruches einiger Tricholoma-Arten
und von Lepiota bucknallii. Z. Pilzkunde 34: 153-158.
JANCSÓ G. (1990): Gombák szaga. Mikológiai Közlemények. 1990/1-3: 63-88;
rövidített változata: http://www.kfki.hu/~cheminfo/hun/teazo/jancso/gomba.html
JOERGES J., KÜTTNER A., GALIZIA C.G., MENZEL R. (1997): Representations
of odours and odour mixtures visualized in the honeybee brain. Nature 387:
285-288.
KAWABE T., MORITA H. (1993): Volatile components in culture fluid of
Polyporus tuberaster. J. Agric. Food Chem. 41: 637-640.
KAWABE T., MORITA H. (1994): Production of benzaldehyde and benzyl
alcohol by he mushroom Polyporus tuberaster K2606. J. Agric. Food Chem.
42: 2556-2560.
KIBBY G. (2000): Hyphal ends. Field Mycology 1: 108.
KLAASSEN (1964): Waarnemingen bij de Grote Stinkzwam. Coolia 11: 29.
LAATSCH H., MATTHIES L. (1992): The characteristic odor of Coprinus
picaceus: a rapid enrichment procedure for apolar, volatile indoles. Mycologia
84: 264-266.
LARGENT D.L., BRADSHAW D.E., WOOD W.F. (1990): The candy-like odor
of Nolanea fructufragrans. Mycologia 82: 786-787.
LE LOCH-BONAZZI C., WOLFF E. (1991): Characterization of the flavour
properties of the cultivated mushroom (Agaricus bisporus) and the influence
of drying processes. Lebensm.-Wiss. u. Technol. 24: 386-390.
LIST P.H., FREUND B. (1968): Geruchsstoffe der Stinkmorchel Phallus
impudicus. Planta Medica 16: 123.
MAGA J.A. (1976): The potential of certain fungi as sources for natural
flavour compounds. Chem. Senses Flavor 2: 255-262.
MALNIC B., HIRONO J., SATO T., BUCK L.B. (1999): Combinatorial receptor
codes for odors. Cell 96: 713-723.
MAU J.-L., BEELMAN R.B., ZIEGLER G.R. (1992): 1-octen-3-ol in the cultivated
mushroom, Agaricus bisporus. J. Food Sci. 57: 704-706.
MAZZA R. (1998): Introduzione alla ˝micosmologia˝. Pagine di Micologia
10: 29-96.
MITCHELL D. (1999): Mushroom tutorial.
http://central.vislab.usyd.edu.au/resources/applications/database/Mineset/tutorials/mushroom1_tut.htm
MOSER M. (1983) in GAMS H.: Die Röhrlinge und Blätterpilze. Kleine
Kryptogamenflora IIb/2, Gustav-Fischer-Verlag, Jena.
NEVILLE P. (1999): Utilisée dans la détermination des champignons,
la sensation gustato-olfactive, caract?re objectif ou subjective? Bull.
Fédér. Ass. Mycol. Médit., N.S. 16: 28-34.
NEY K.H., FREYTAG W.G. (1980): Trüffel-Aroma. Gordian 80: 214.
NOORDELOOS M.E. (1980): Entoloma subgenus Nolanea in the Netherlands
and adjacent regions with a reconnaissance of its remaining taxa in Europe.
Persoonia 10: 427-534.
OVERTON S.V., MANURA J.J. (1999): Determination of volatile organic
compounds in mushrooms. http://www.sisweb.com/referenc/applnote/app-18-a.htm
PACIONI G., BELLINA-AGOSTINONE C., D´ANTONIO M. (1990): Odour composition
of the Tuber melanosporum complex. Mycol. Res. 94: 201-204.
PACIONI G., BELLINA-AGOSTINONE C., D´ANTONIO M. (1991): On the odour
of Tuber mesentericum. Mycol. Res. 95: 1016-1017.
PELUSIO F., NILSSON T., MONTANARELLA L., TILIO R., LARSEN B., FACCHETTI
S., MADSEN J.O. (1995): Headspace solid-phase microextraction analysis
of volatile organic sulfur-compounds in black-and-white truffle aroma.
J. Agric. Food Chem. 43: 2138-2143.
PRISZTER SZ. (1988): A nagygombák magyar és latin névjegyzéke. Mikológiai
Közl. 88/1-2: 1-158.
RAPIOR S., BREHERET S., TALOU T., BESSI?RE J.-M. (1997): Volatile flavor
constituents of fresh Marasmius alliaceus (garlic Marasmius). J. Agric.
Food Chem. 45: 820-825.
RAPIOR S., BREHERET S., TALOU T., PELISSIER Y., MILHAU M., BESSIERE
J.-M. (1998): Volatile components of fresh Agrocybe aegerita and Tricholoma
sulfureum. Cryptogamie, Mycol. 19: 15-23.
RAPIOR S., FONS F., BESSI?RE J.-M. (2000): The fenugreek odor of Lactarius
helvus. Mycologia 92: 305-308.
RAPIOR S., FRUCHIER A., BESSI?RE J.-M. (1997): Volatile aroma constituents
of Agarics and Boletes. Recent Res. Devel. in Phytochem. 1: 567-584.
RAPIOR S., KONSKA G., GUILLOT J., ANDARY C., BESSIERE J.-M. (2000):
Volatile composition of Laetiporus sulpureus. Cryptogamie, Mycol. 21: 67-72.
RAPIOR S., MAURUC M.-J., GUINBERTEAU J., MASSON C.-L., BESSI?RE J.-M.
(2001): Volatile composition of Gyrophragmium dunalii. Mycologia 92: 1043-1046.
RUBIN B.D., KATZ L.C. (2001): Spatial coding of enantiomers in the
rat olfactory bulb. Nature Neuroscience 4: 355-356.
SCHMITT J.A., KLOSE W. (1973): Notiz über den Duftstoff des Blätterpilzes
Rhodophyllus icterinus (Fr.) Quél. Liebigs Ann. Chem. 1973: 544-546.
STIJVE T. (1999): Geruch- und Farbstoffe der Rutenpilze. Schweiz. Z.
Pilzkunde 77: 63-70.
TALOU T., DELMAS M., GASET A. (1987): Principal constituents of black
truffle (Tuber melanosporum) aroma. J. Agric. Food Chem. 35: 774-777.
TRESSL R., BAHRI D., ENGEL K.-H. (1982): Formation of eight-carbon
and ten-carbon components in mushrooms (Agaricus campestris). J. Agric.
Food Chem. 30: 89-93.
TURIN L. (1996): A spectroscopic mechanism for primary olfactory reception.
Chem. Senses 21: 773-791.
VICKERS N.J., CHRISTENSEN T.A., BAKER T.C., HILDEBRAND J.G. (2001):
Odour-plume dynamics influence the brain’s olfactory code. Nature 410:
466-470.
WATSON R.L., LARGENT D.L., WOOD W.F. (1986): The “coal tar” odor of
Tricholoma inamoenum. Mycologia 78: 965-966.
WOOD W.F., BRANDES M.L., WATSON R.L., JONES R.L., LARGENT D.L. (1994):
trans-2-nonenal, the cucumber odor of mushrooms. Mycologia 86: 561-563.
WOOD W. F., BROWNSON M., SMUDDE R.A. (1992): 2-aminobenzaldehyde: the
source of the “sweet odor” of Hebeloma sacchariolens. Mycologia 84: 935-936.
WOOD W.F., DESHAZER D.A., LARGENT D.L. (1988): The identity and metabolic
fate of volatiles responsible for the odor of Hydnellum suaveolens. Mycologia
80: 252-255.
WOOD W.F., WATSON R.L., LARGENT D.L. (1990): The odor of Agaricus augustus.
Mycologia 82: 276-278.
WOODALL A. (2000): ˝Comparisons are odorous...˝ (Shakespeare: much
ado about nothing). Field Mycology 1: 40-41; .Fungal smells – the final(?)
answers. Field Mycology 1: 132.
XANDERS (1991): Xanders sechsundzwanzigster Pilzbrief. Die Pilzgerüche.
Schweiz. Z. Pilzkunde 69: 183-186.